Содержание
- 2. ג- молярная (эквивалентная) проводимость электролита объмом в 1см3 на расстоянии 1 см между электродами ג =
- 3. При с→0, т.е. при разбавлении, растворов электролитов ג увеличивается и принимает значение ∞ג .В сильных электролитах
- 4. Задача O Х0,5 э H3C-C при 250С=0,0009ом-1∙см-1 OH ג ∞ =34,5 ом-1∙см2∙моль-1. Вычислить рНр-ра; степень диссоциации
- 5. Закон Кольрауша: Рассчитать ג ∞ для H2SO4; Решение: ג ∞ H2SO4=2ג ∞ H++ ג ∞ SO4
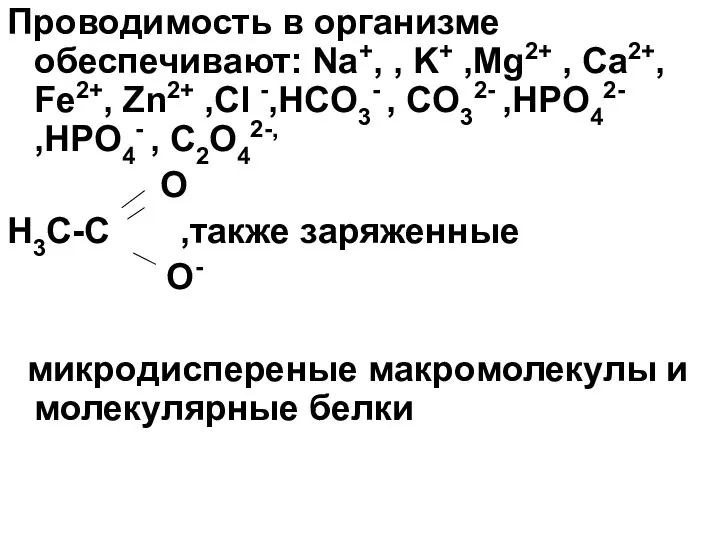
- 6. Проводимость в организме обеспечивают: Na+, , K+ ,Mg2+ , Ca2+, Fe2+, Zn2+ ,Cl -,HCO3- , CO32-
- 7. Название Кровь Плазма крови Жел. Сок СМЖ Моча Мышечная ткань Нервная ткань Жировая ткань Кожа Кость
- 8. При заболевании почек Х мочи Уменьшается→1,38→0,06 При диабете→1,44→0,9 Электродный потенциал : - это работа движения 96500
- 10. Скачать презентацию






 Ландшафтный дизайн. Дренаж, декоративные покрытия дорожек
Ландшафтный дизайн. Дренаж, декоративные покрытия дорожек Колесные пары
Колесные пары Сучасні молодіжні субкультури
Сучасні молодіжні субкультури Прямые выплаты на территории Забайкальского края. Фонд социального страхования РФ
Прямые выплаты на территории Забайкальского края. Фонд социального страхования РФ Презентация "Художественная культура Античности" - скачать презентации по МХК
Презентация "Художественная культура Античности" - скачать презентации по МХК ТРАНСПОРТНЫЕ МОДЕЛИ
ТРАНСПОРТНЫЕ МОДЕЛИ НЕРАВЕНСТВА С ДВУМЯ ПЕРЕМЕННЫМИ Алгебра, 9 класс.
НЕРАВЕНСТВА С ДВУМЯ ПЕРЕМЕННЫМИ Алгебра, 9 класс. Блогерство в YouTube
Блогерство в YouTube Мы боремся со стрессом и побеждаем. Подготовила: Четвергова Любовь Николаевна
Мы боремся со стрессом и побеждаем. Подготовила: Четвергова Любовь Николаевна  Методика обучения баскетболу в школе
Методика обучения баскетболу в школе Презентация по предмету «Микроэкономика» на тему:
Презентация по предмету «Микроэкономика» на тему: Автор презентации Коровина Ирина Николаевна учитель начальных классов МБОУ «СОШ №9» г.Сафоново Смоленской области
Автор презентации Коровина Ирина Николаевна учитель начальных классов МБОУ «СОШ №9» г.Сафоново Смоленской области  Презентация Халва
Презентация Халва Характеристика возбуждения и торможения в ЦНС.
Характеристика возбуждения и торможения в ЦНС. Тайна цвета
Тайна цвета Полюс повороту
Полюс повороту Добро пожаловать на семинар колористика. Просто о сложном
Добро пожаловать на семинар колористика. Просто о сложном PHP #1.1. Введение. Быстрый старт
PHP #1.1. Введение. Быстрый старт Нагрузки на раму
Нагрузки на раму Экстремальное программирование. Рефакторинг
Экстремальное программирование. Рефакторинг Моторика
Моторика Производство ремонтно-строительных работ. Ремонт фундаментов, стен и перегородок зданий. (Тема 2.2)
Производство ремонтно-строительных работ. Ремонт фундаментов, стен и перегородок зданий. (Тема 2.2) Информационные ресурсы Интернет. Всемирная паутина
Информационные ресурсы Интернет. Всемирная паутина Оценка эффективности реконструкции очистных сооружений предприятия ВКХ Минской обл
Оценка эффективности реконструкции очистных сооружений предприятия ВКХ Минской обл ПРЕЗЕНТАЦИЯ Теория развития цивилизаций А.Тойнби.
ПРЕЗЕНТАЦИЯ Теория развития цивилизаций А.Тойнби. Система нормирования электронного государства
Система нормирования электронного государства Noţiunea, obiectul şi sistemul dreptului ecologic
Noţiunea, obiectul şi sistemul dreptului ecologic МУКА!!! Высочайшее качество!
МУКА!!! Высочайшее качество!