Содержание
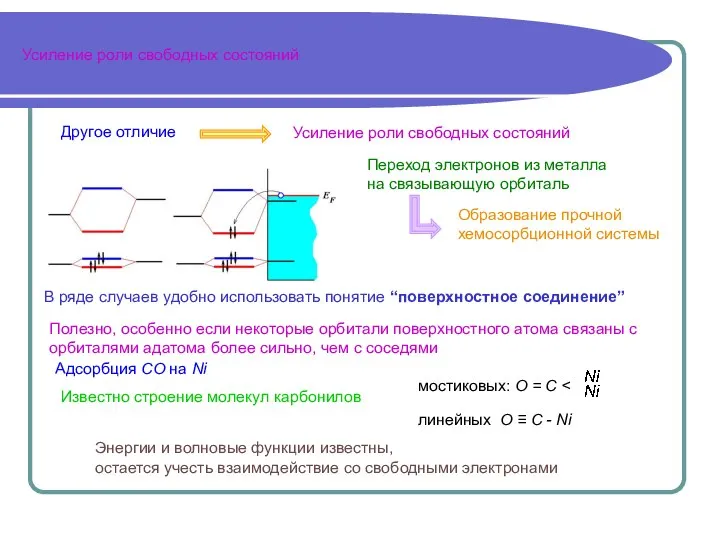
- 2. Усиление роли свободных состояний Усиление роли свободных состояний Переход электронов из металла на связывающую орбиталь В
- 3. Слабое взаимодействие несколько сдвигает и расширяет уровни Слабое взаимодействие несколько сдвигает и расширяет уровни При сильном
- 4. Важна электронная структуры адчастицы Важна электронная структуры адчастицы Десорбция атомов 5d-металлов с граней вольфрама Максимум зависимости
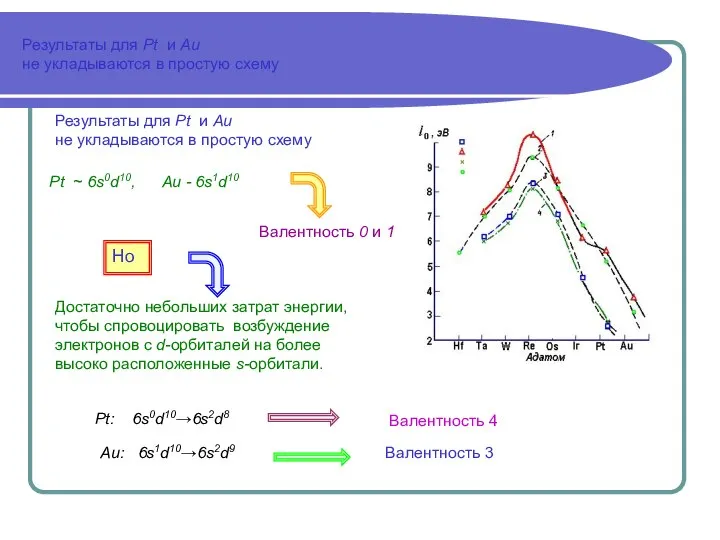
- 5. Результаты для Pt и Au не укладываются в простую схему Результаты для Pt и Au не
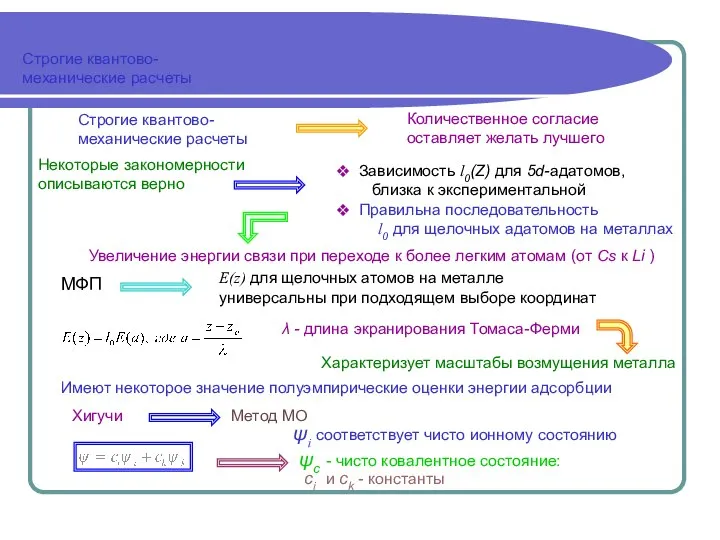
- 6. Строгие квантово- механические расчеты Строгие квантово- механические расчеты Некоторые закономерности описываются верно Зависимость l0(Z) для 5d-адатомов,
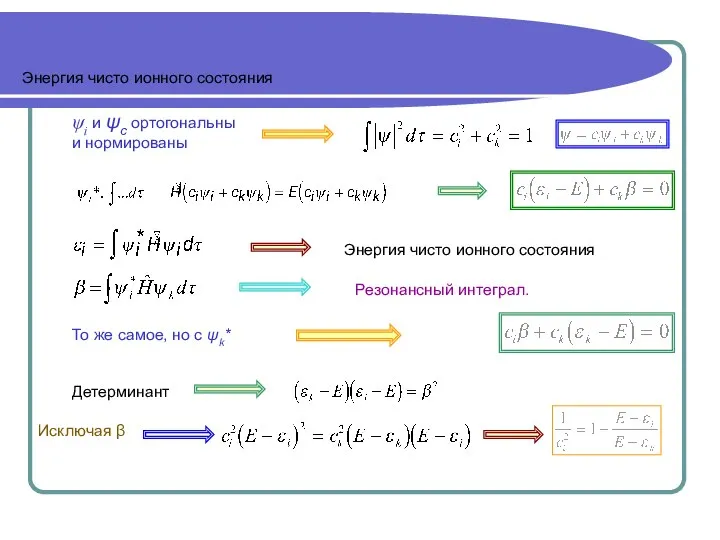
- 7. Энергия чисто ионного состояния Энергия чисто ионного состояния Детерминант ψi и ψс ортогональны и нормированы Исключая
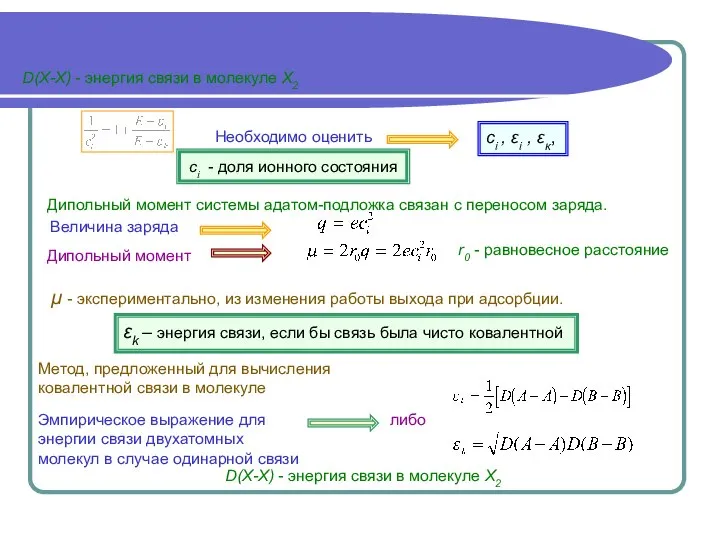
- 8. D(X-X) - энергия связи в молекуле Х2 D(X-X) - энергия связи в молекуле Х2 либо Эмпирическое
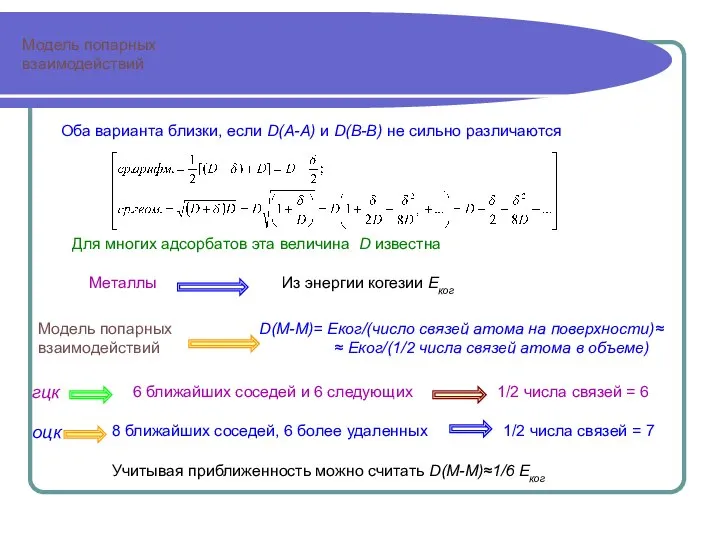
- 9. Модель попарных взаимодействий Модель попарных взаимодействий гцк 6 ближайших соседей и 6 следующих 1/2 числа связей
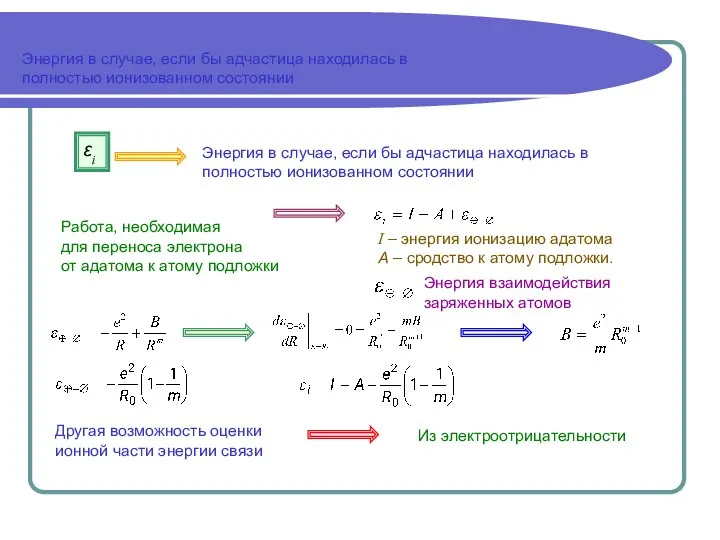
- 10. Энергия в случае, если бы адчастица находилась в полностью ионизованном состоянии Энергия в случае, если бы
- 11. Cs 0,7 A, B и С в порядке уменьшения электроотрицательности Способность атома притягивать электрон (Полинг) Электроотрицательность
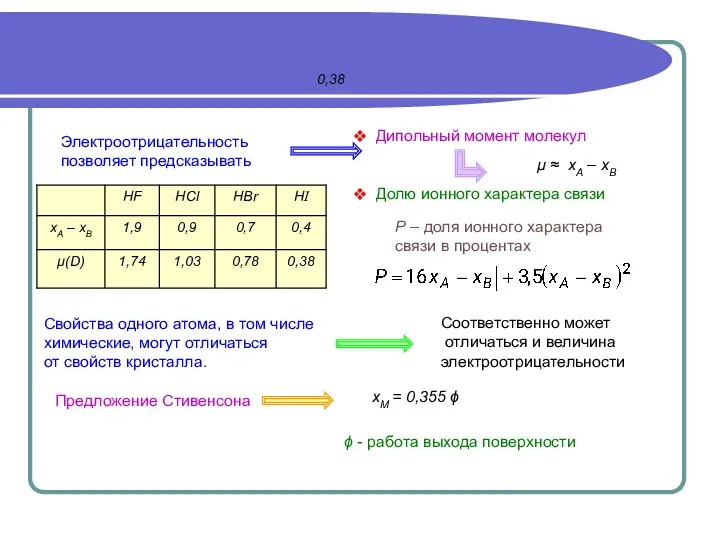
- 12. 0,38 Электроотрицательность позволяет предсказывать Дипольный момент молекул Долю ионного характера связи Р – доля ионного характера
- 13. Взаимодействие не 2-х атомов, а атома с поверхностью Взаимодействие не 2-х атомов, а атома с поверхностью
- 14. l0 убывает с уменьшением плотности атомов на грани l0 убывает с уменьшением плотности атомов на грани
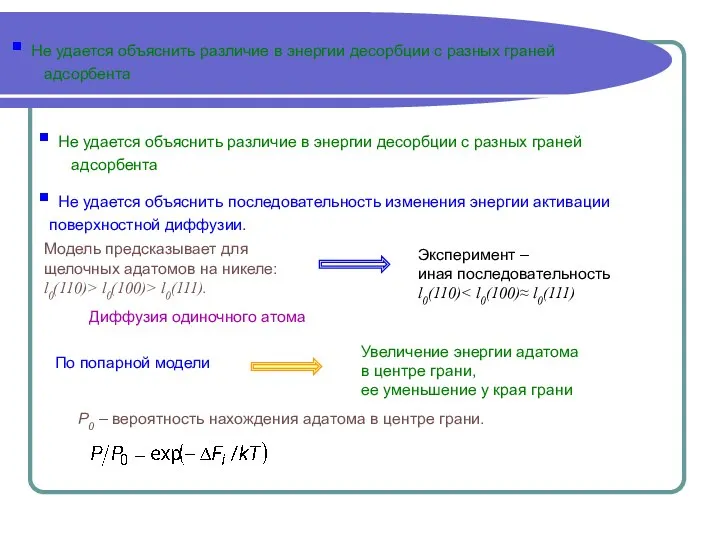
- 15. Не удается объяснить различие в энергии десорбции с разных граней адсорбента Не удается объяснить различие в
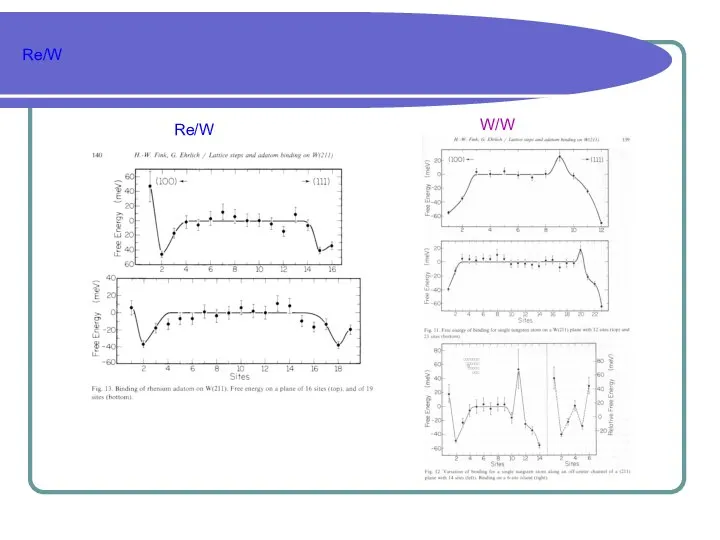
- 16. Re/W Re/W W/W
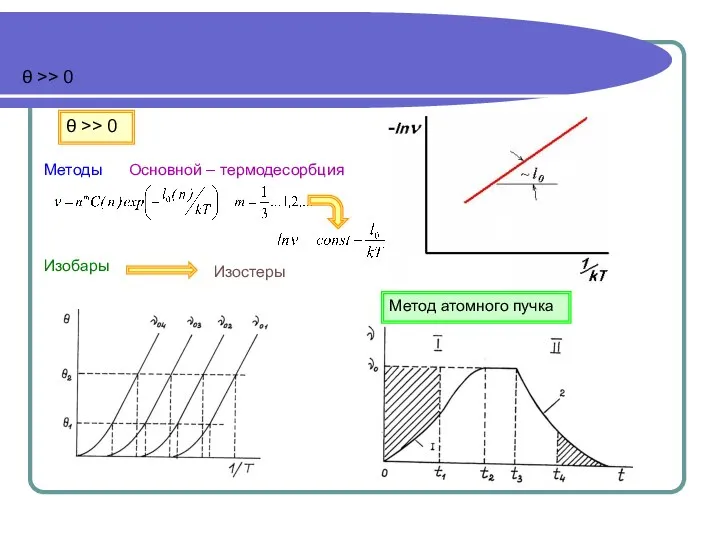
- 17. θ >> 0 θ >> 0 Методы Основной – термодесорбция Изобары Изостеры Метод атомного пучка
- 19. Скачать презентацию





 Заклепочные соединения
Заклепочные соединения Состояние и развитие ВЭД нефтяной отрасли России Карташова Галина Т-093
Состояние и развитие ВЭД нефтяной отрасли России Карташова Галина Т-093  Презентация "Экономика как наука" - скачать презентации по Экономике
Презентация "Экономика как наука" - скачать презентации по Экономике 6 урок
6 урок Как празнуваме Нова година Проекти на учениците от 3. клас 4.ОУ „Димчо Дебелянов“ Благоевград
Как празнуваме Нова година Проекти на учениците от 3. клас 4.ОУ „Димчо Дебелянов“ Благоевград Cost-benefit analysis Анализ «издержки-выгоды» Выполнила: Калиновская М.В. 4 курс политологии ГУ-ВШЭ
Cost-benefit analysis Анализ «издержки-выгоды» Выполнила: Калиновская М.В. 4 курс политологии ГУ-ВШЭ  Анализ текста как подготовка рабочих материалов к написанию сочинения – рассуждения (части С ЕГЭ). Формулируем, комментируем, ар
Анализ текста как подготовка рабочих материалов к написанию сочинения – рассуждения (части С ЕГЭ). Формулируем, комментируем, ар Как найти клиентов и не потерять деньги в интернете
Как найти клиентов и не потерять деньги в интернете  ГТО - путь к здоровью
ГТО - путь к здоровью Сложение натуральных чисел.
Сложение натуральных чисел.  Family and relations 1
Family and relations 1 Современные высокотехнологичные решения для строительной отрасли, в сфере эксплуатации транспорта и различной техники
Современные высокотехнологичные решения для строительной отрасли, в сфере эксплуатации транспорта и различной техники Воздушно-десантная подготовка. Основы прыжка с парашютом, ТТХ ПС Д-6с4, особые случаи при совершении прыжка. (Тема 1)
Воздушно-десантная подготовка. Основы прыжка с парашютом, ТТХ ПС Д-6с4, особые случаи при совершении прыжка. (Тема 1) Софийский собор
Софийский собор Муниципальное общеобразовательное учреждение гимназия № 15 им.Н.Н.Белоусова Основы педагогического мастерства г. Сочи, 2009
Муниципальное общеобразовательное учреждение гимназия № 15 им.Н.Н.Белоусова Основы педагогического мастерства г. Сочи, 2009 Этапы торгового визита Шпаргалка для торгового представителя
Этапы торгового визита Шпаргалка для торгового представителя ПО ПРИМЕРАМ РАБОТ РУССКИХ ХУДОЖНИКОВ XIX ВЕКА
ПО ПРИМЕРАМ РАБОТ РУССКИХ ХУДОЖНИКОВ XIX ВЕКА Осуществление деятельностного подхода к образованию через интерактивный урок
Осуществление деятельностного подхода к образованию через интерактивный урок РЕОЛОГИЯ КРОВИ
РЕОЛОГИЯ КРОВИ Основы алгоритмизации и программирования
Основы алгоритмизации и программирования Библиотека STL. Классы string, vector
Библиотека STL. Классы string, vector Расчет ветроколеса с горизонтальной осью
Расчет ветроколеса с горизонтальной осью Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Das intelligente Haus
Das intelligente Haus Психологическая подготовка к ЕГЭ Рекомендации ведущих российских психологов
Психологическая подготовка к ЕГЭ Рекомендации ведущих российских психологов Визы Российской Федерации
Визы Российской Федерации Народный промысел – «Гжель»
Народный промысел – «Гжель» Схемы использования аккредитива при сделках с недвижимостью Плательщик – покупатель товаров/услуги возможность использо
Схемы использования аккредитива при сделках с недвижимостью Плательщик – покупатель товаров/услуги возможность использо