Содержание
- 2. Взаимодействие с водой Схема взаимодействия Ме+Н2О=Ме(ОН)n+Н2 Металл –восстановитель, Н+ из воды - окислитель Если: ЕМе Металл
- 3. Если: ЕМе Металл в воде не растворяется при стандартных условиях (250С, СМе2+=1 моль/л), но может растворяться
- 4. Если ЕМе>ЕН2, то второе условие неважно, поскольку реакция запрещена с точки зрения термодинамики. В этом случае
- 5. Взаимодействие с растворами щелочей Реакция протекает в две стадии: Ме+Н2О=Ме(ОН)n+Н2 – ОВР Ме(ОН)n +КОН=Кх[Ме(ОН)у] – не
- 6. Например: Взаимодействие калия с раствором NaОН: ЕК К+Н2О + NaOH ≠ 2) Взаимодействие алюминия раствором КОН:
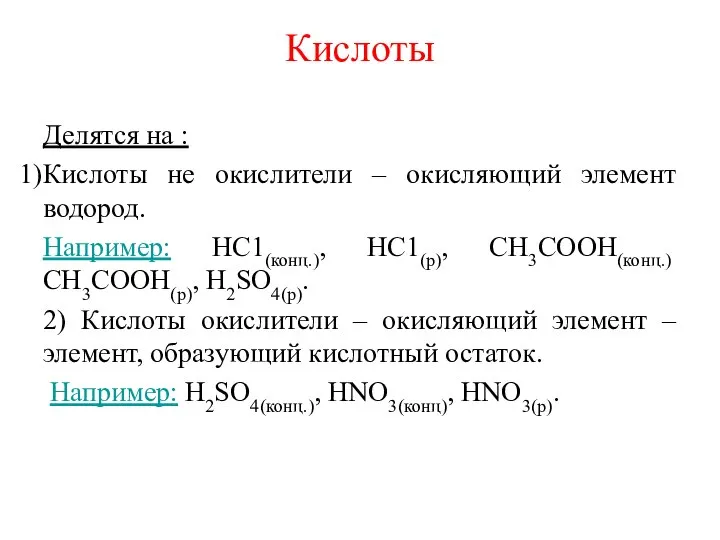
- 7. Кислоты Делятся на : Кислоты не окислители – окисляющий элемент водород. Например: НС1(конц.), НС1(р), СН3СООН(конц.) СН3СООН(р),
- 8. Кислоты - не окислители Схема взаимодействия: Ме+кислота=соль+Н2 Возможно взаимодействие, если: 1)ЕМе Например: 1) Взаимодействие магния с
- 9. Кислоты-окислители Схема взаимодействия: Ме+кислота=соль+Н2О+продукт восстановления Продукт восстановления зависит от активности металла и концентрации кислоты. Н2SO4: Активный
- 11. Скачать презентацию







 Язык программирования Python
Язык программирования Python Основы электротехники. Электрические машины
Основы электротехники. Электрические машины классификация кинематических пар
классификация кинематических пар Методы повышения точности средств измерений
Методы повышения точности средств измерений Тем.3.Зан.3.ppt
Тем.3.Зан.3.ppt Синтаксис оператора
Синтаксис оператора Политические идеи Аристотеля и современность
Политические идеи Аристотеля и современность Аксонометрические проекции
Аксонометрические проекции ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ
ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ Чувашские народные праздники
Чувашские народные праздники Презентация на тему "Введение федеральных государственных требований (ФГТ) в систему дошкольного образования" - скачать през
Презентация на тему "Введение федеральных государственных требований (ФГТ) в систему дошкольного образования" - скачать през КОМПЛЕКСНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ PR: ОТ СТРАТЕГИЧЕСКИХ ЦЕЛЕЙ К СИСТЕМЕ КПЭ КОМПЛЕКСНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ PR: ОТ СТРАТЕГИЧЕСКИХ Ц
КОМПЛЕКСНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ PR: ОТ СТРАТЕГИЧЕСКИХ ЦЕЛЕЙ К СИСТЕМЕ КПЭ КОМПЛЕКСНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ PR: ОТ СТРАТЕГИЧЕСКИХ Ц Подбор персонала для строительной компании
Подбор персонала для строительной компании РОЛЬ ПОЛОВЫХ СТЕРОИДНЫХ ГОРМОНОВ И ПРОЛАКТИНА В ПАТОГЕНЕЗЕ
РОЛЬ ПОЛОВЫХ СТЕРОИДНЫХ ГОРМОНОВ И ПРОЛАКТИНА В ПАТОГЕНЕЗЕ  Крупнейшие художественные музеи страны
Крупнейшие художественные музеи страны Строительные рабочие, организация труда, заработная плата. Система оплаты труда
Строительные рабочие, организация труда, заработная плата. Система оплаты труда ЭКСПЕРТИЗА ШОКОЛАДА
ЭКСПЕРТИЗА ШОКОЛАДА Дзюдо в детском саду. Учебная программа составлена с учётом возраста обучающихся (мальчики и девочки) – 5-7 лет
Дзюдо в детском саду. Учебная программа составлена с учётом возраста обучающихся (мальчики и девочки) – 5-7 лет Операционная система
Операционная система e4-71f55eac
e4-71f55eac Idea for my business. Салон удивительной мебел
Idea for my business. Салон удивительной мебел Легкая атлетика
Легкая атлетика Презентация на тему "мое портфолио" - скачать презентации по Педагогике
Презентация на тему "мое портфолио" - скачать презентации по Педагогике Что такое общество_10 кл
Что такое общество_10 кл Понятие, содержание и признаки права
Понятие, содержание и признаки права Направления и принципы физического воспитания
Направления и принципы физического воспитания Гибридные автомобили. Схема гибридного автомобиля
Гибридные автомобили. Схема гибридного автомобиля Двоичные деревья
Двоичные деревья