Содержание
- 2. Основополагающая концепция для сильных электролитов ‒ высокая концентрация ионов в растворе и, как результат, электростатического взаимодействия
- 3. Понятия теории Дебая ‒ Хюккеля Активность Ионная сила раствора
- 4. Активность (а) – … … концентрационный параметр; определяется как величина, подстановка которой вместо концентрации в термодинамические
- 5. Активность а = γ · с а – активность вещества, моль/дм3; γ – молярный коэффициент (безразмерная
- 6. Ионная сила раствора (I) – … … величина, характеризующая силу электростатического воздействия ионов в растворе электролита.
- 7. Правило ионной силы «Коэффициенты активности элемента, а, следовательно, и коэффициенты активности его ионов зависят от ионной
- 8. Зависимость γ ионов от I раствора
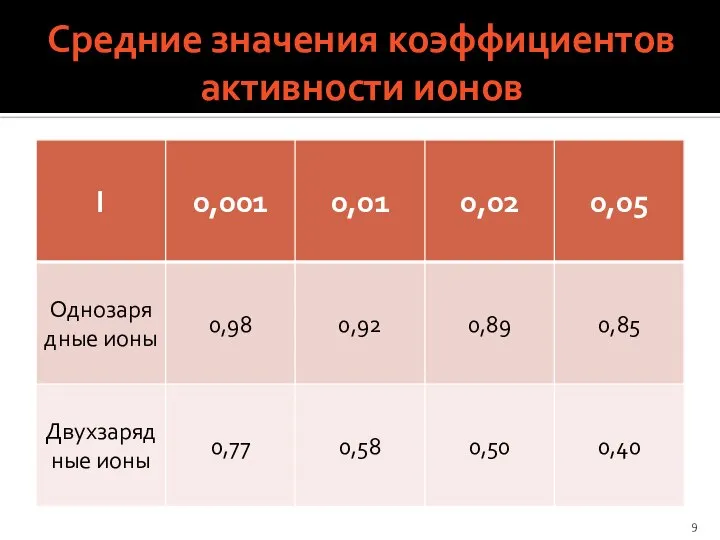
- 9. Средние значения коэффициентов активности ионов
- 10. Вокруг каждого иона в растворе образуется ионная атмосфера за счёт электростатического притяжения ионов различного заряда. Ионная
- 11. Предельный закон Дебая – Хюккеля … … связывает размер и плотность ионной атмосферы с термодинамической характеристикой
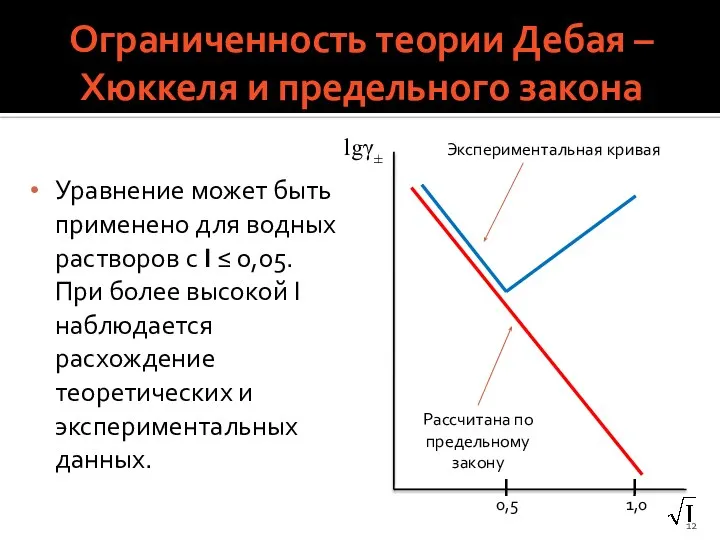
- 12. Ограниченность теории Дебая – Хюккеля и предельного закона Уравнение может быть применено для водных растворов с
- 14. Скачать презентацию









 Финансовый рынок и его инструменты
Финансовый рынок и его инструменты ЗНО-2015
ЗНО-2015 Портфолио Графический дизайн и визуальные решения. - презентация
Портфолио Графический дизайн и визуальные решения. - презентация Гигиена воды
Гигиена воды Правописание звонких и глухих согласных на конце слова 2 класс
Правописание звонких и глухих согласных на конце слова 2 класс Презентация на тему "Развитие креативных способностей младших школьников средствами творческих заданий в учебном процессе"
Презентация на тему "Развитие креативных способностей младших школьников средствами творческих заданий в учебном процессе"  Гиперкуб. Как сделано первое здание в “Сколково”
Гиперкуб. Как сделано первое здание в “Сколково” Команды и функции системы Maxima
Команды и функции системы Maxima BН100 service training
BН100 service training NP-полнота
NP-полнота ДРЛ-5-8 класс
ДРЛ-5-8 класс Профессия врач-хирург Подготовила Ворончихина Ольга 9 А класс
Профессия врач-хирург Подготовила Ворончихина Ольга 9 А класс Подготовка к работе В МЕЖДУНАРОДНЫХ МАКСИ - ПРОЕКТАХ И МИНИ- ПРОЕКТАХ «КЛАСС-КЛАСС», «УЧИТЕЛЬ-УЧИТЕЛЬ» С ИСПОЛЬЗОВАНИЕМ СОВРЕМЕННЫ
Подготовка к работе В МЕЖДУНАРОДНЫХ МАКСИ - ПРОЕКТАХ И МИНИ- ПРОЕКТАХ «КЛАСС-КЛАСС», «УЧИТЕЛЬ-УЧИТЕЛЬ» С ИСПОЛЬЗОВАНИЕМ СОВРЕМЕННЫ «Энциклопедия одного слова или, почему ХЛЕБ хлебом называют…» Выполнил Ученик 5 «Б» класса Москвин Илья Руководитель проекта Учитель русского языка и литературы Москвина Марина Александровна
«Энциклопедия одного слова или, почему ХЛЕБ хлебом называют…» Выполнил Ученик 5 «Б» класса Москвин Илья Руководитель проекта Учитель русского языка и литературы Москвина Марина Александровна Конструкторская и технологическая документация
Конструкторская и технологическая документация Рак гортани
Рак гортани  Таможенный кодекс ТС как новый нормативно-правовой документ Выполнила: Студентка 3 курса, группы Э093 Мишина Дарья
Таможенный кодекс ТС как новый нормативно-правовой документ Выполнила: Студентка 3 курса, группы Э093 Мишина Дарья Связи между классами. Объектно-ориентированное программирование. (Лекция 3)
Связи между классами. Объектно-ориентированное программирование. (Лекция 3) Мода из комода
Мода из комода Демократія
Демократія Как помочь ребенку в период подростковых изменений?
Как помочь ребенку в период подростковых изменений? Культура Западной Европы в XI-XV веках
Культура Западной Европы в XI-XV веках Франчайзинг: разработка проекта советы и примеры для сети розничных магазинов одежды среднего сегмента. - презентация
Франчайзинг: разработка проекта советы и примеры для сети розничных магазинов одежды среднего сегмента. - презентация Плавание как вид спорта
Плавание как вид спорта Объекты и содержание права полного хозяйственного ведения и права оперативного управления
Объекты и содержание права полного хозяйственного ведения и права оперативного управления  Презентация Наследственное право
Презентация Наследственное право Сложные условия на Паскале
Сложные условия на Паскале Интерактивный плакат "Компьютерные коммуникации"
Интерактивный плакат "Компьютерные коммуникации"