Содержание
- 2. Ферменты – биологические катализаторы. Почти все ферменты – белки. Однако известно небольшое число молекул РНК, обладающих
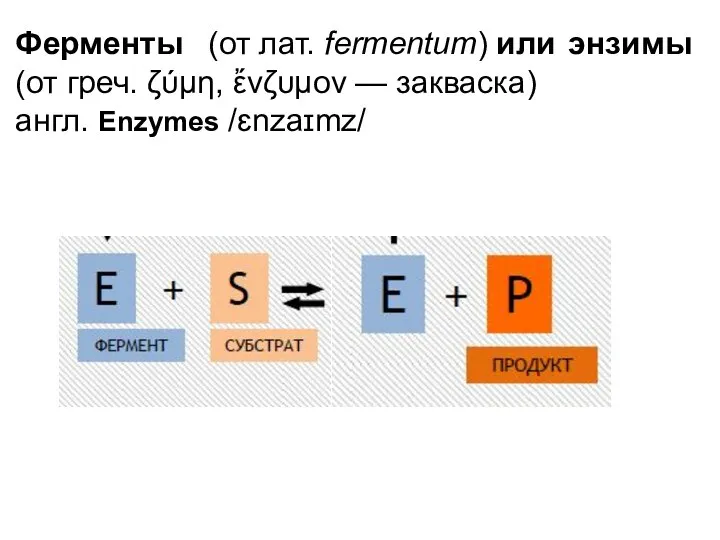
- 3. Ферменты (от лат. fermentum) или энзимы (от греч. ζύμη, ἔνζυμον — закваска) англ. Enzymes /ɛnzaɪmz/
- 4. Общие свойства ферментов Ферменты не сдвигают равновесие реакции 2. Ферменты снижают энергию активации для катализируемых ими
- 6. Свойства ферментов как катализаторов: Высокая каталитическая активность. Высокая специфичность. 3. Лабильность – чувствительность к условиям среды
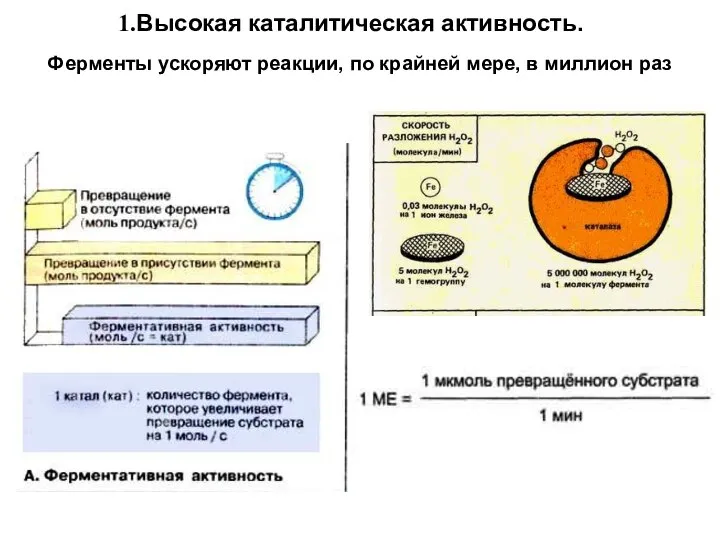
- 7. Высокая каталитическая активность. Ферменты ускоряют реакции, по крайней мере, в миллион раз
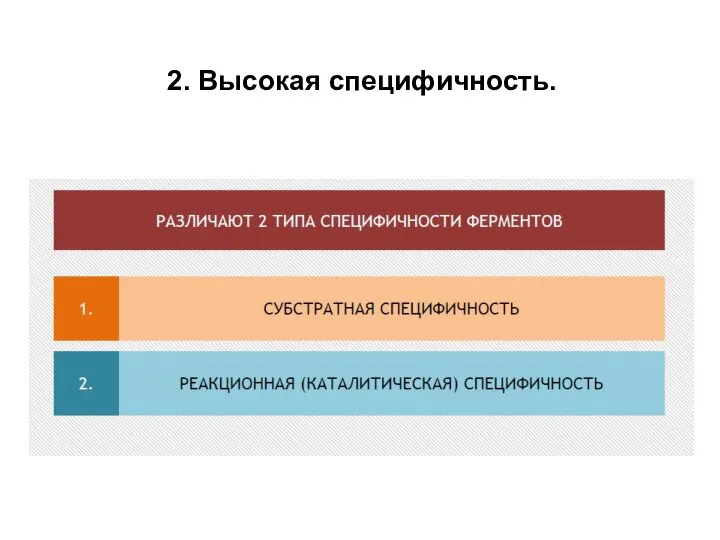
- 10. 2. Высокая специфичность.
- 11. Реакционная специфичность - это способность фермента ускорять только определенный тип каталитических реакций. (каталитическая)
- 12. Субстратная специфичность - это способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
- 13. Абсолютная специфичность – это способность фермента катализировать реакцию только с одним субстратом
- 15. Пример действия липазы А
- 16. Стереоспецифичность – способность фермента катализировать реакцию только с определенным стереоизомером субстрата. 1. Стереоспецифичность к D-сахарам. Большинство
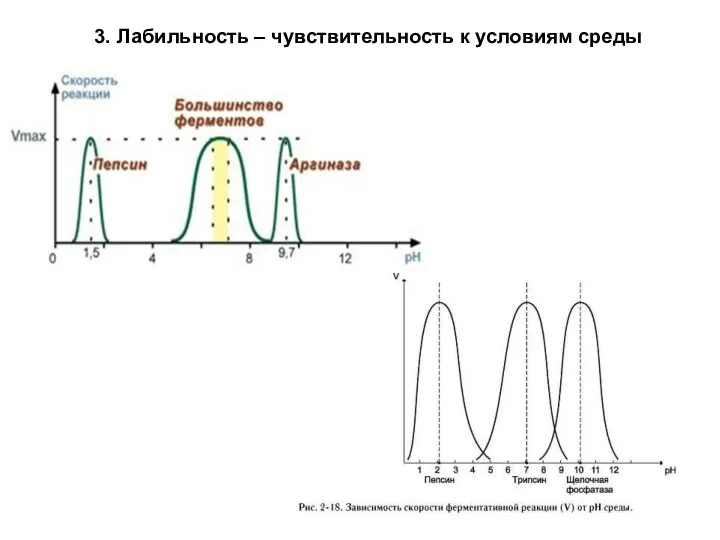
- 18. 3. Лабильность – чувствительность к условиям среды
- 21. 4. Активность ферментов может регулироваться.
- 22. Активность ферментов в клетке непостоянна во времени. Она чутко реагирует на ситуацию, в которой оказывается клетка,
- 25. 4. Ограниченный (частичный) протеолиз проферментов. Т.к. синтез некоторых ферментов осуществляется в виде более крупного предшественника (трипсиноген,
- 27. Аллостерическая регуляция. Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие
- 28. В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса, продукт данной реакции, т.е работает механизм
- 29. Фермент фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются
- 32. Локализация ферментов в клетке
- 38. Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда
- 39. Строение ферментов и общие принципы их функционирования
- 40. Первым этапом катализа является образование фермент-субстратного комплекса. При этом субстрат связывается с активным центром фермента. Активный
- 41. Общие свойства активных центров: На активный центр приходится относительно малая часть от общего количества аминокислот фермента.
- 42. Лизоцим – первичная структура. Аминокислотные остатки активного центра - красные
- 45. Основные модели, объясняющие специфичность взаимодействия фермента и субстрата: Модель ключ – замок. 2. Модель индуцированного соответствия.
- 47. Субстрат Фермент Активный центр
- 48. Фермент-субстратный комплекс
- 49. 2. Гипотеза Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному
- 50. 2. Модель индуцированного соответствия. Фермент Фермент- субстратный комплекс Активный центр приспосабливается к форме субстрата Субстрат Активный
- 51. Взаимодействие субстрата и фермента согласно модели «индуцированного соответствия»: 1. При связывании субстрата происходит изменение формы фермента.
- 54. Кинетика ферментативных реакций
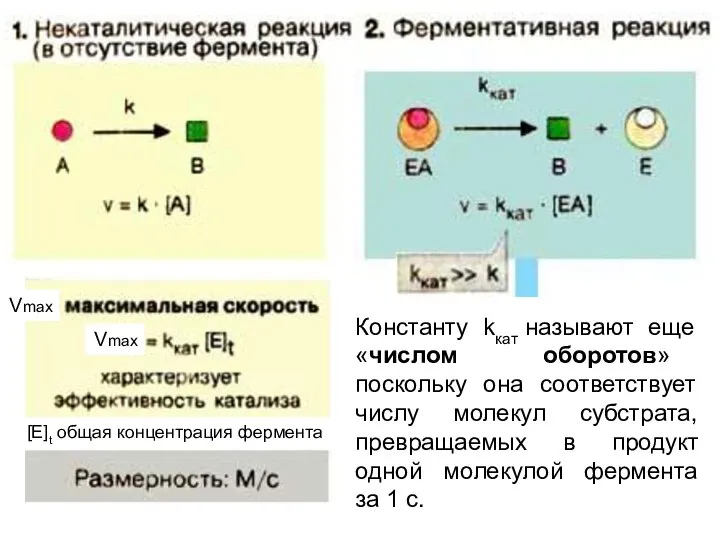
- 55. Vmax Константу kкат называют еще «числом оборотов» поскольку она соответствует числу молекул субстрата, превращаемых в продукт
- 56. В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора,
- 57. - субстрат - фермент
- 58. Номер пробирки → Концентрация субстрата в мкМ → Скорость реакции (V0) мкМ/мин → Скорость реакции (V0)
- 59. А – субстрат, [А] – концентрация свободного субстрата E – фермент [E] – концентрация свободного фермента
- 60. Основная предпосылка: Образование фермент-субстратного комплекса – необходимый промежуточный этап катализа. Скорость реакции пропорциональна концентрации фермент-субстратных комплексов.
- 61. Уравнение Михаэлиса-Ментен если Vmax = kkat ● [E]t
- 62. Зависимость скорости ферментативной реакции от концентрации субстрата [А] V, кат Vmax Vmax / 2 KM При
- 63. Константа Михаэлиса (Km)численно равна той концентрации субстрата [A], при которой V достигает половины максимальной величины (Vmax/2).
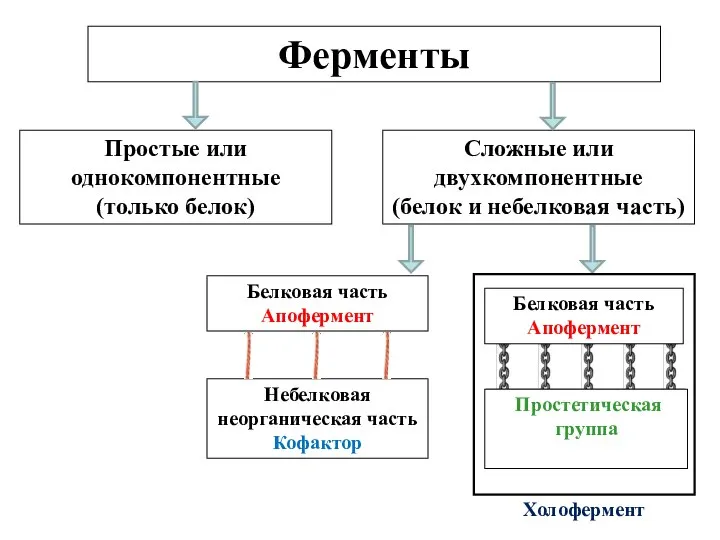
- 64. Ферменты Простые или однокомпонентные (только белок) Сложные или двухкомпонентные (белок и небелковая часть) Белковая часть Апофермент
- 65. Небелковая часть сложного фермента Неорганическая Кофактор Органическая Кофермент Пиридоксальфосфат (B6) Биотин (H) Тиаминпирофосфат (B1) ФМН, ФАД
- 68. Кофермент можно рассматривать как второй субстрат или косубстрат. Лактат- дегидрогеназа
- 69. Коферменты участвуют в метаболизме как переносчики различных химических групп (в том числе и водорода). Например в
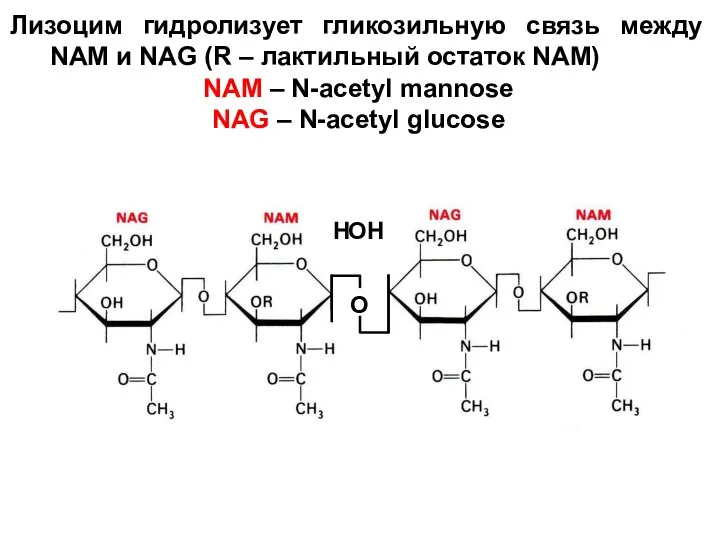
- 71. Лизоцим гидролизует гликозильную связь между NAM и NAG (R – лактильный остаток NAM) NAM – N-acetyl
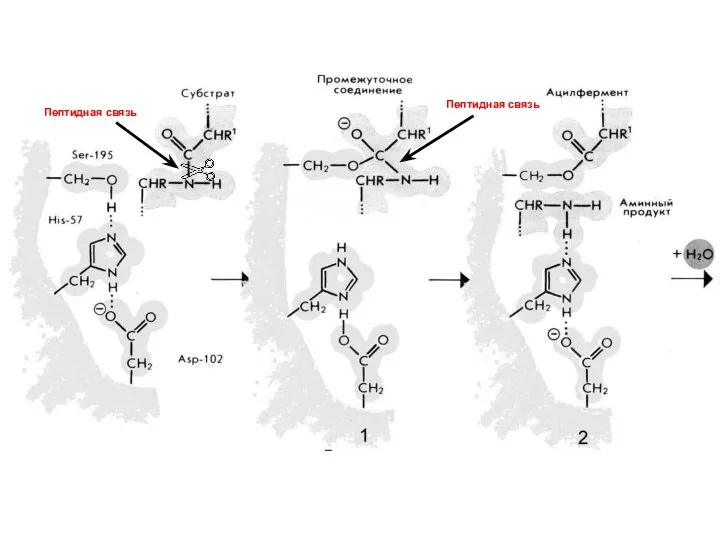
- 72. 2. Протеолитическая реакция как пример каталитической активности фермента Например: Трипсин Трипсин (КФ 3.4.21.4) — фермент класса
- 75. Пептидная связь
- 76. Пептидная связь Пептидная связь
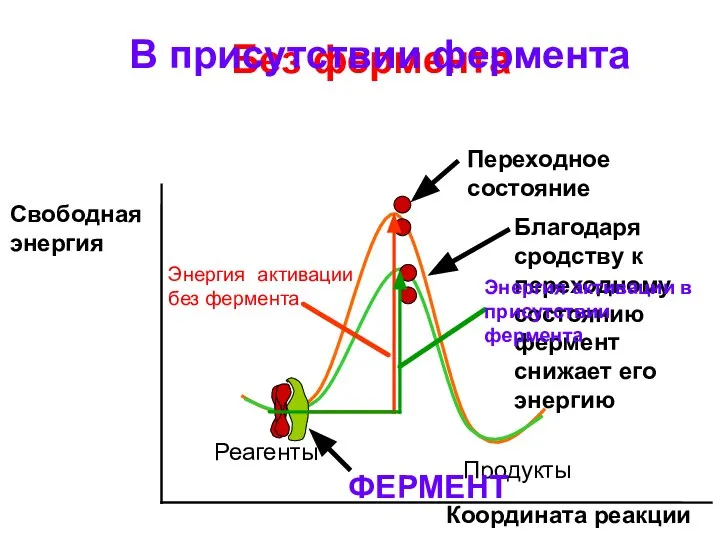
- 78. Фермент ускоряет реакцию за счет снижения энергии активации
- 79. Энергия молекул Число молекул с данной энергией Распределение молекул реагирующего вещества по энергии EA – Энергия
- 80. Механизм катализа заключается в связывании субстрата, при этом фермент заставляет его принимать форму переходного состояния Переходное
- 81. Рассмотрим реакцию разложения угольной кислоты (не ферментативной реакцией) Н2СО3 → Н2О + СО2 Угольная кислота слабая;
- 82. При достижении энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений.
- 83. Координата реакции Свободная энергия Реагенты Продукты Переходное состояние Без фермента В присутствии фермента Благодаря сродству к
- 84. Метаболический путь - это сеть ферментативных реакций, в которой продукт одной реакции является субстратом другой
- 88. Скачать презентацию




















































![А – субстрат, [А] – концентрация свободного субстрата E – фермент](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/723368/slide-58.jpg)

![Уравнение Михаэлиса-Ментен если Vmax = kkat ● [E]t](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/723368/slide-60.jpg)
![Зависимость скорости ферментативной реакции от концентрации субстрата [А] V, кат Vmax](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/723368/slide-61.jpg)
![Константа Михаэлиса (Km)численно равна той концентрации субстрата [A], при которой V](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/723368/slide-62.jpg)



















 Морские обитатели. Скаты
Морские обитатели. Скаты Человек Проблема: как правильно жить, чтобы как дольше сохранить здоровье и работоспособность
Человек Проблема: как правильно жить, чтобы как дольше сохранить здоровье и работоспособность НАШ ЗЕЛЕНЫЙ МИР Викторина для шестиклассников составила Деркач С.О. МОУ СОШ №1 г. Тверь
НАШ ЗЕЛЕНЫЙ МИР Викторина для шестиклассников составила Деркач С.О. МОУ СОШ №1 г. Тверь Основные группы тканей
Основные группы тканей Животные похожие на людей
Животные похожие на людей 05.1 Стрекающие
05.1 Стрекающие Эколого-биохимическая характеристика почв и подорожника большого (Plantago Major) из районов г. Самары
Эколого-биохимическая характеристика почв и подорожника большого (Plantago Major) из районов г. Самары Презентация на тему Репродуктивная система. Оплодотворение
Презентация на тему Репродуктивная система. Оплодотворение Пчелы. Общее строение тела пчелы
Пчелы. Общее строение тела пчелы Биоритмы - внутренние часы человека
Биоритмы - внутренние часы человека Отряд хищные
Отряд хищные  Положительные стороны вегетарианства
Положительные стороны вегетарианства гигиена зрения
гигиена зрения Строение, функции и значение кожи
Строение, функции и значение кожи Семейство розоцветные
Семейство розоцветные Первозвери. Яйцекладущие и сумчатые
Первозвери. Яйцекладущие и сумчатые Домашний питомец
Домашний питомец Гидра пресноводная
Гидра пресноводная СПИННОЙ МОЗГ. СТРОЕНИЕ Спинной мозг лежит в позвоночном канале представляет собой длинный тяж (его длина у взрослого человека око
СПИННОЙ МОЗГ. СТРОЕНИЕ Спинной мозг лежит в позвоночном канале представляет собой длинный тяж (его длина у взрослого человека око Молекулярная биофизика. Пространственная организация биополимеров
Молекулярная биофизика. Пространственная организация биополимеров Причуды паразитизма
Причуды паразитизма «Хлеб – всему голова» Суслова Е.А. учитель начальных классов ГБОУ СОШ №1 города Кинеля Самарской области
«Хлеб – всему голова» Суслова Е.А. учитель начальных классов ГБОУ СОШ №1 города Кинеля Самарской области  Обобщающий урок по темам: царства Прокариоты, Грибы, Растения. Урок биологии в 7 классе. Учитель Нурисламова Рузалия Салимзян
Обобщающий урок по темам: царства Прокариоты, Грибы, Растения. Урок биологии в 7 классе. Учитель Нурисламова Рузалия Салимзян Адаптация, как результат эволюции
Адаптация, как результат эволюции ГИГИЕНА КОЖИ Программа телеканала «Здоровье»
ГИГИЕНА КОЖИ Программа телеканала «Здоровье» Физиология пищеварения
Физиология пищеварения Применение методов проточной цитофлуорометрии для научных исследований
Применение методов проточной цитофлуорометрии для научных исследований Органы слуха, равновесия и их анализаторы
Органы слуха, равновесия и их анализаторы