Содержание
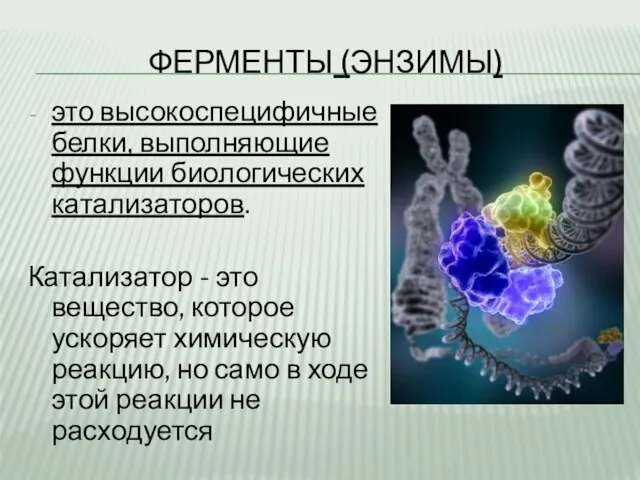
- 2. ФЕРМЕНТЫ (ЭНЗИМЫ) это высокоспецифичные белки, выполняющие функции биологических катализаторов. Катализатор - это вещество, которое ускоряет химическую
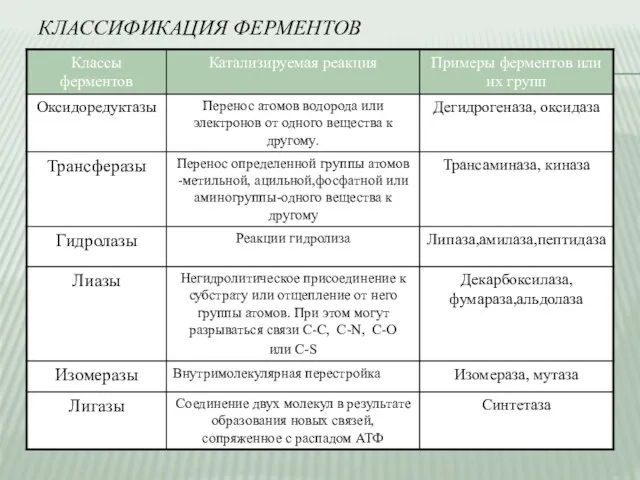
- 3. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
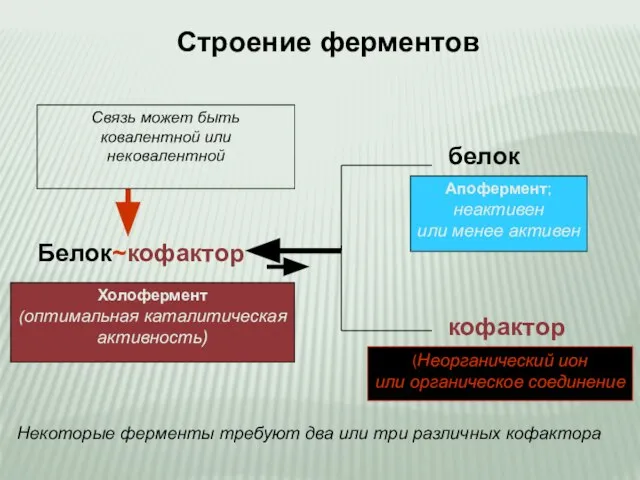
- 4. Белок~кофактор белок кофактор Связь может быть ковалентной или нековалентной Холофермент (оптимальная каталитическая активность) Апофермент; неактивен или
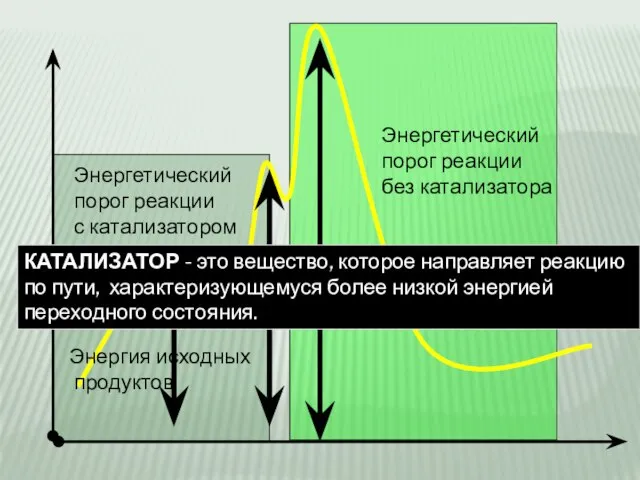
- 5. Энергия исходных продуктов Энергетический порог реакции без катализатора Энергетический порог реакции с катализатором КАТАЛИЗАТОР - это
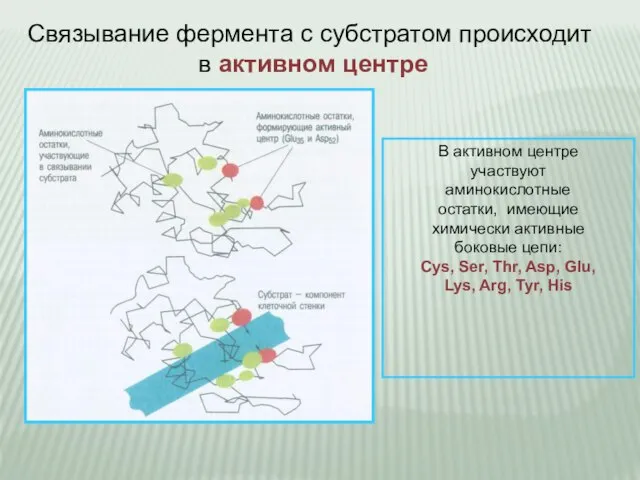
- 6. Связывание фермента с субстратом происходит в активном центре В активном центре участвуют аминокислотные остатки, имеющие химически
- 7. Высокая избирательность действия фермента обеспечивается тем, что субстрат связывается в активном центре фермента в нескольких точках
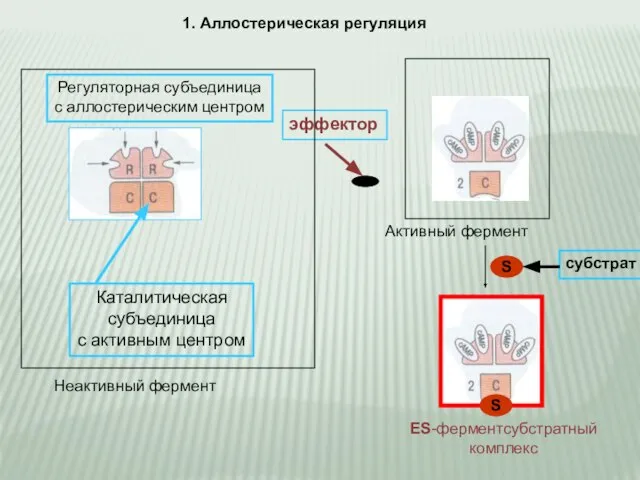
- 8. Способы регуляции: 1. Аллостерическая регуляция 2. Ковалентная модификация 3. Диссоциация неактивного предшественника (зимогена), на активный фермент
- 9. 1. Аллостерическая регуляция эффектор Каталитическая субъединица с активным центром Неактивный фермент Регуляторная субъединица с аллостерическим центром
- 10. 2. Ковалентная модификация Неактивный Е СН2ОН Акт.Е СН2О-РО3Н2 АТР АDP Н3РО4 Фосфорилирование - дефосфорилирование a) б)
- 11. Регуляция действия ферментов E4 E3 E2 E1 A B C D P Ингибирование по принципу обратной
- 12. ИНГИБИТОРЫ специфические неспецифические обратимые необратимые конкурентные неконкурентные
- 13. Необратимое ингибирование путем ковалентной модификации Фермент - ацетилхолин- эстераза Ингибитор - диизопропил- фторфосфат Неактивный фермент
- 14. Обратимое ингибирование ферментов Конкурентное ингибирование Неконкурентное ингибирование E EI ES E + P I E ES
- 15. Иммобилизация фермента - закрепление на полимерном носителе (полистироле) Иммобилизованный фермент не смешивается с продуктами реакции, более
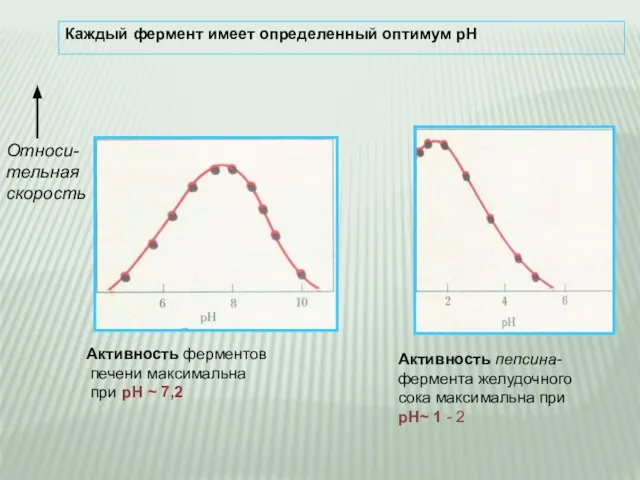
- 16. Каждый фермент имеет определенный оптимум рН Относи- тельная скорость Активность пепсина- фермента желудочного сока максимальна при
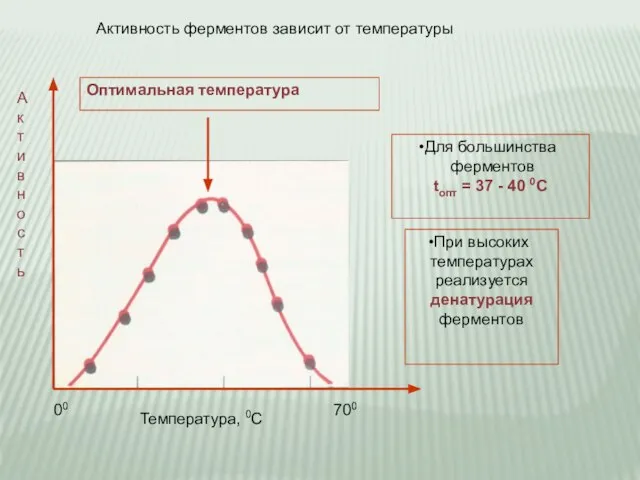
- 17. Оптимальная температура 00 700 Активность ферментов зависит от температуры А к т и в н о
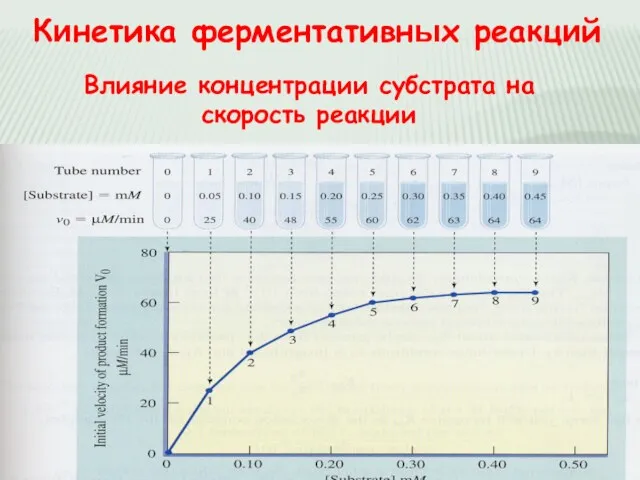
- 18. Кинетика ферментативных реакций Влияние концентрации субстрата на скорость реакции
- 19. УРАВНЕНИЕ МИХАЭЛИСА-МЕНТЕН В чем его смысл? — Позволяет получить формальные характеристики скорости ферментативной реакции вида Уравнение
- 20. Анализ уравнения Михаэлиса -Ментен 3. Km = [S], тогда V0 = 1/2 Vmax Vmax [S] Km
- 21. СМЫСЛ KM Km выводится из констант скоростей Km в условиях Михаэлиса-Ментен определяет скорость распада фермент-субстратного комплекса
- 23. Скачать презентацию









![Анализ уравнения Михаэлиса -Ментен 3. Km = [S], тогда V0 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/544300/slide-19.jpg)

 Проводящие ткани
Проводящие ткани Происхождение растений. Основные этапы развития растительного мира
Происхождение растений. Основные этапы развития растительного мира Размножение та розвиток земноводних
Размножение та розвиток земноводних Чем вода полезна в жизни человека?
Чем вода полезна в жизни человека? Презентация на тему "Класс Млекопитающие или звери" - скачать презентации по Биологии
Презентация на тему "Класс Млекопитающие или звери" - скачать презентации по Биологии Теории происхождения человека
Теории происхождения человека Размножение декоративных растений. Классификация растений по декоративным качествам и направлениям использования в садоводстве
Размножение декоративных растений. Классификация растений по декоративным качествам и направлениям использования в садоводстве Строение головного мозга
Строение головного мозга Цветок - орган семенного размноженич
Цветок - орган семенного размноженич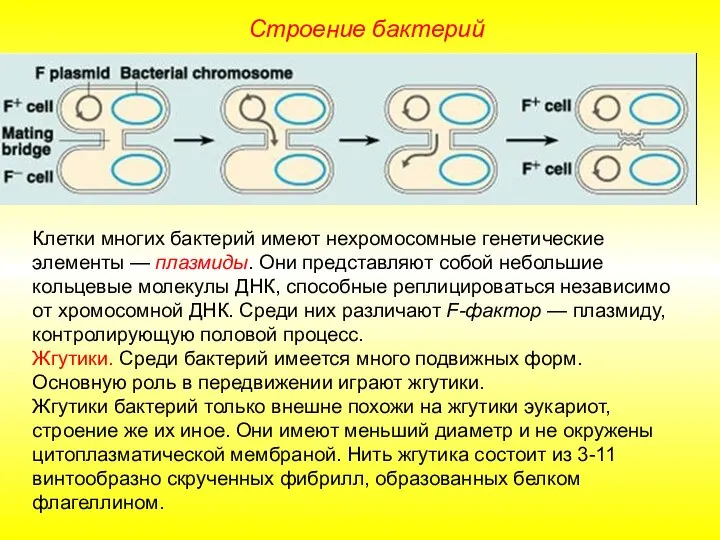 Презентация на тему "Строение бактерий" - скачать презентации по Биологии
Презентация на тему "Строение бактерий" - скачать презентации по Биологии Птицы. Птичьи разговоры
Птицы. Птичьи разговоры Митоз и мейоз
Митоз и мейоз Семейство розоцветные
Семейство розоцветные Учение Вернадского о биосфере
Учение Вернадского о биосфере Презентация на тему Плоскостопие
Презентация на тему Плоскостопие  Класс Млекопитающие (Звери)
Класс Млекопитающие (Звери) Теория филэмбриогенезов
Теория филэмбриогенезов Медузы
Медузы Хвороба Ебола Підготувала Учениця 11-А Безнощенко Валентина
Хвороба Ебола Підготувала Учениця 11-А Безнощенко Валентина  Методы размножения организмов
Методы размножения организмов Генетически-модифицированные организмы
Генетически-модифицированные организмы Population
Population Урок-практикум по решению задач по генетике
Урок-практикум по решению задач по генетике Культивирование и выделение чистых культур анаэробов
Культивирование и выделение чистых культур анаэробов Вплив різних видів фізичної активності на діяльність серця. Регуляція діяльності серця при фізичному навантаженні
Вплив різних видів фізичної активності на діяльність серця. Регуляція діяльності серця при фізичному навантаженні Разнообразие декоративных кустарников в моём городе
Разнообразие декоративных кустарников в моём городе Физиология микроорганизмов
Физиология микроорганизмов В гости к весне. Апрель
В гости к весне. Апрель