Содержание
- 2. Эмбрион мыши, 8 сут.: соотношение процессов гаструляции и нейруляции
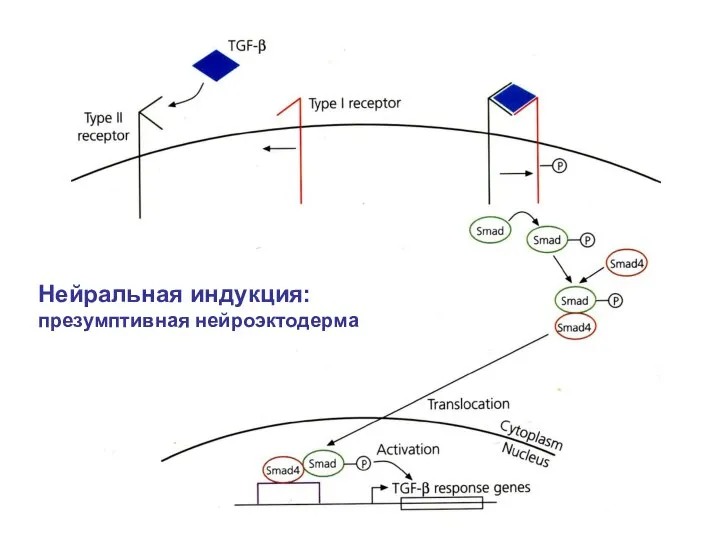
- 3. Нейральная индукция: презумптивная нейроэктодерма
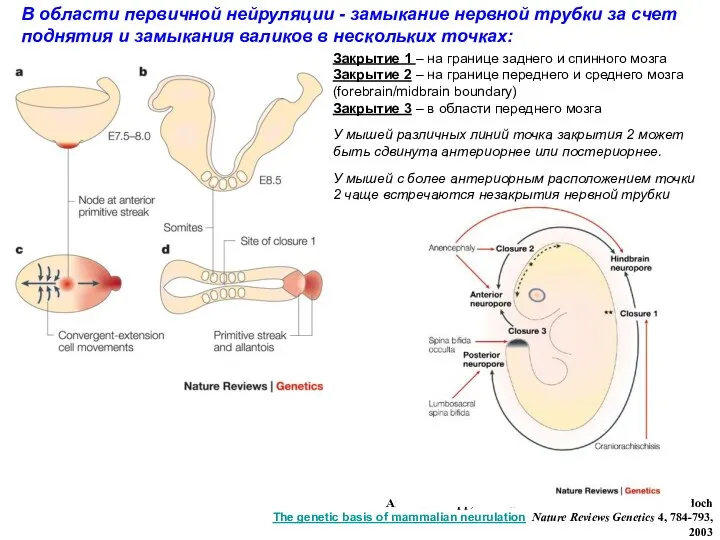
- 4. Первичная нейруляция (до крестцового отдела) – формирование нервных валиков и их смыкание с образованием трубки. Вторичная
- 5. Эмбрион человека: Формирование нервной трубки
- 6. Закрытие нервных валиков в краниальной области 1 этап: Двояковыпуклые нервные валики поднимаются за счет пролиферации и
- 7. Andrew J. Copp, Nicholas D. E. Greene & Jennifer N. Murdoch The genetic basis of mammalian
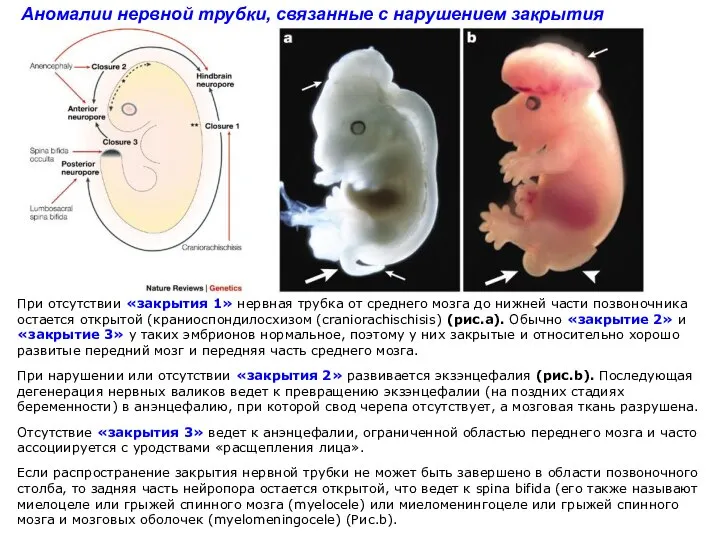
- 8. Аномалии нервной трубки, связанные с нарушением закрытия При отсутствии «закрытия 1» нервная трубка от среднего мозга
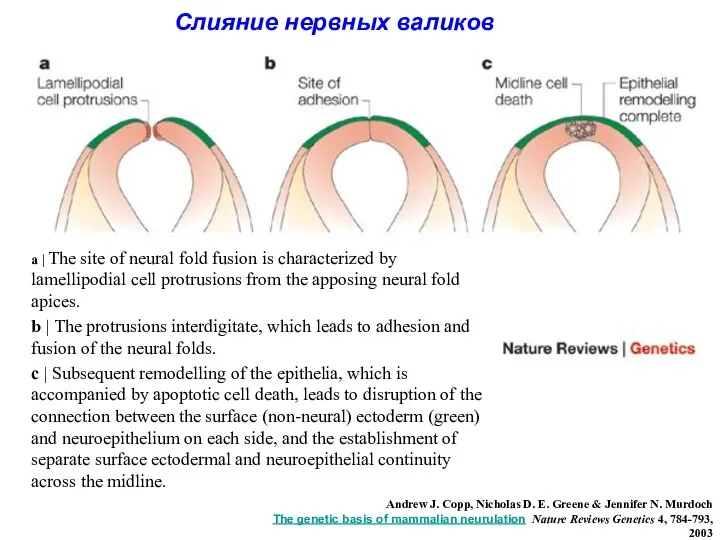
- 9. a | The site of neural fold fusion is characterized by lamellipodial cell protrusions from the
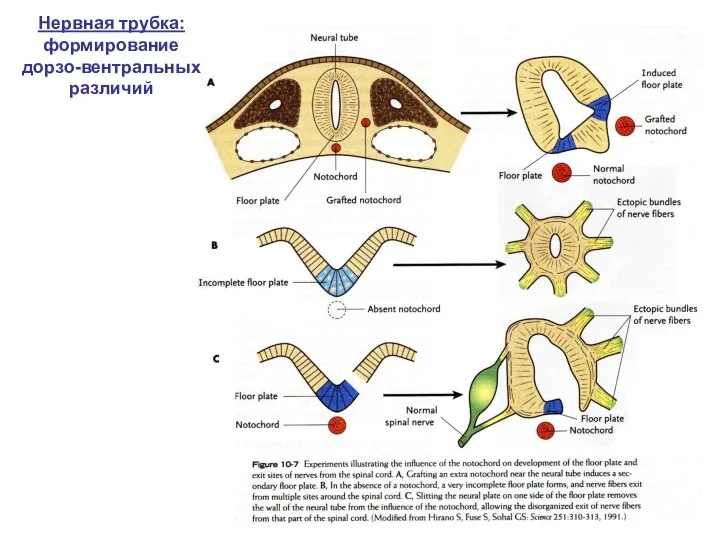
- 10. Нервная трубка: формирование дорзо-вентральных различий
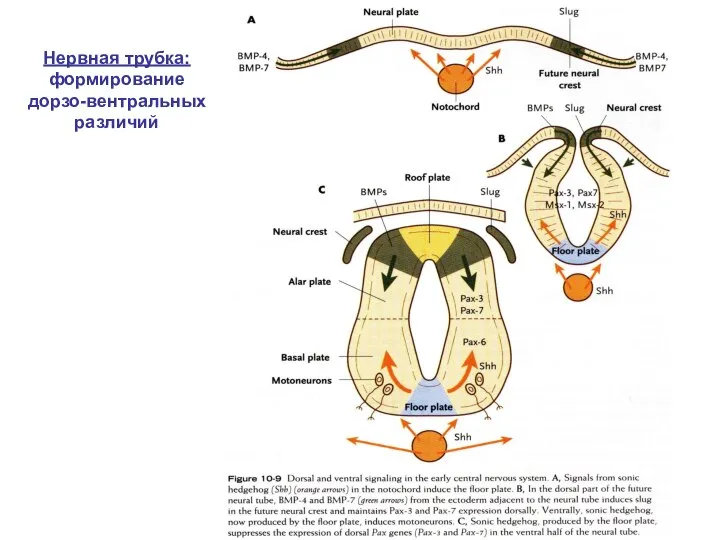
- 11. Нервная трубка: формирование дорзо-вентральных различий
- 12. Спецификация клеток нервной трубки: Региональная экспрессия факторов транскрипции (Mash, Lim, Pax и др.) и Сигнальных молекул
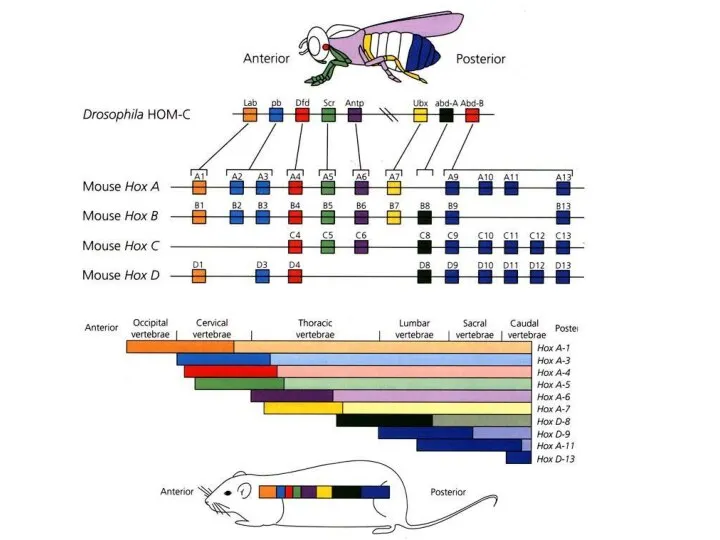
- 13. Нервная трубка: Формирование антериально-постериальных различий 6-8 сут. развития эмбриона мыши
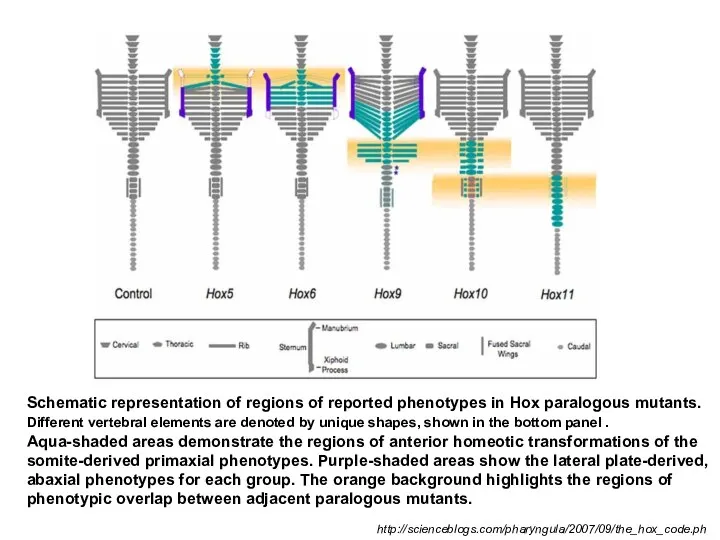
- 16. Schematic representation of regions of reported phenotypes in Hox paralogous mutants. Different vertebral elements are denoted
- 18. Сегментация головного мозга: стрелками указаны сигнальные зоны Нервная трубка: Формирование антериально-постериальных различий
- 19. Нервная система: другие антериально-постериальные паттерны экспрессии генов СП ГБ
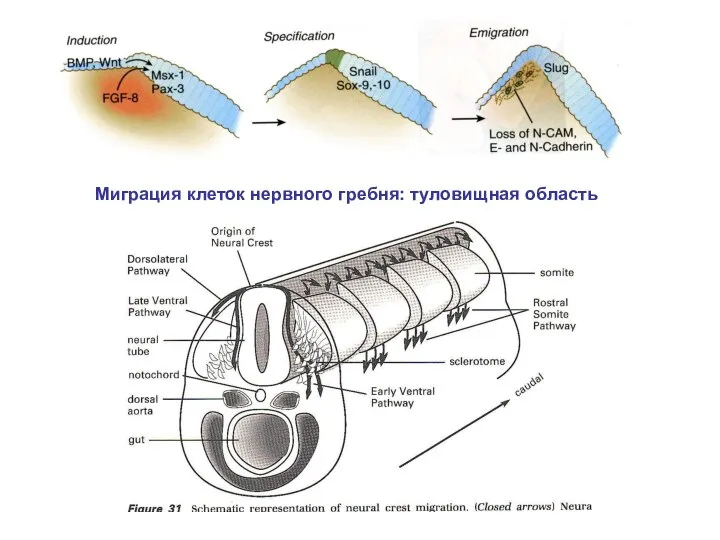
- 20. Миграция клеток нервного гребня: туловищная область
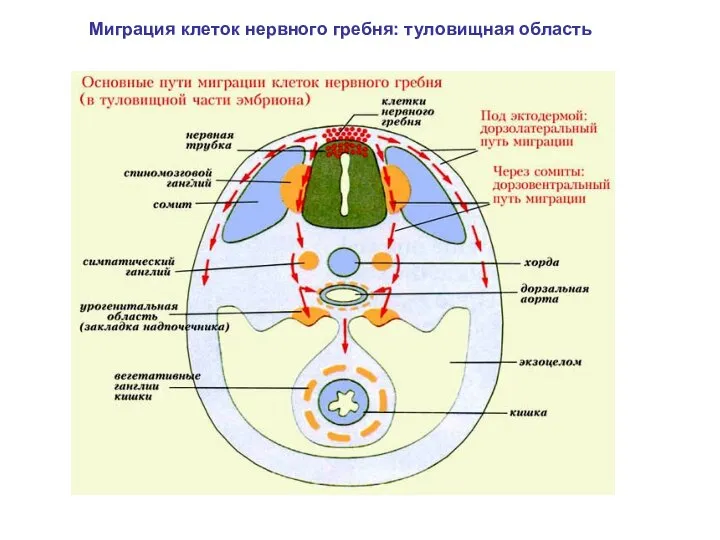
- 21. Миграция клеток нервного гребня: туловищная область
- 22. ромбомеры и жаберные дуги: миграция клеток НГ ромбомеры и жаберные дуги: экспрессия НОХ-генов Миграция клеток нервного
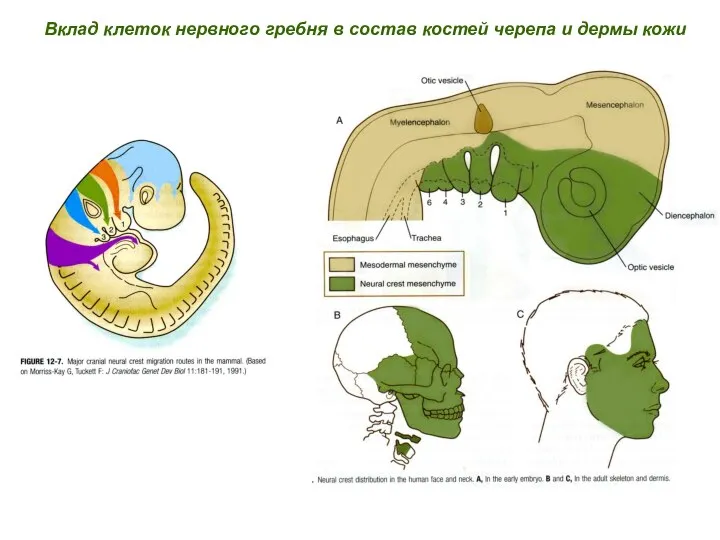
- 23. Вклад клеток нервного гребня в состав костей черепа и дермы кожи
- 24. Судьба клеток нервного гребня, мигрирующих каудальнее 6-й жаберной дуги
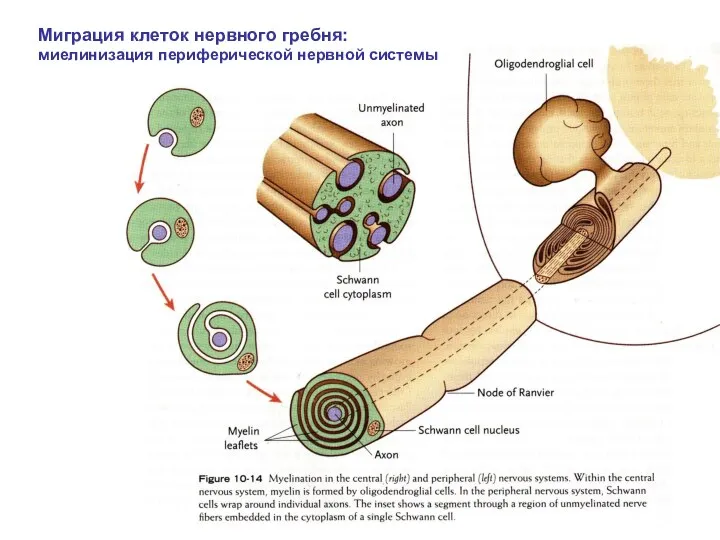
- 26. Миграция клеток нервного гребня: миелинизация периферической нервной системы
- 28. Спецификация нейральных и глиальных клеток: латеральное ингибирование У млекопитающих: Notch 1 ранний маркер глиальных клеток, потом
- 29. The Notch pathway Активируется в ответ на межклеточное ('trans') взаимодействие трансмембранного лиганда Delta и трансмембранного рецептора
- 30. Ассиметричные деления в нейроэктодерме.
- 31. 1 — вентрикулярная зона (слой тел глиальных клеток); 2 — субвентрикулярная зона; 3— промежуточная зона; 4
- 32. Экспрессия рецептора G-CSF отчётливо выявляет клетки радиальной глии в разных отделах эмбрионального мозга мыши на разных
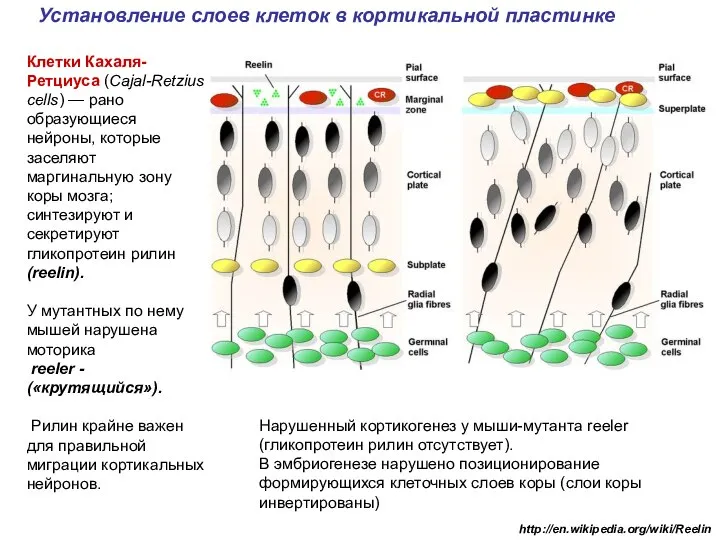
- 33. Установление слоев клеток в кортикальной пластинке http://en.wikipedia.org/wiki/Reelin Клетки Кахаля-Ретциуса (Cajal-Retzius cells) — рано образующиеся нейроны, которые
- 34. поперечный срез закладки спинного мозга
- 37. Скачать презентацию





















 Макроэволюция
Макроэволюция Строение костной системы организма и ее функции. Лекция №3
Строение костной системы организма и ее функции. Лекция №3 Опорно-двигательная система человека
Опорно-двигательная система человека Тесты по биологии
Тесты по биологии Рост и развитие животных
Рост и развитие животных Микробиологическая оценка обсемененности продуктов переработки яблок
Микробиологическая оценка обсемененности продуктов переработки яблок Хвойные растения
Хвойные растения  Строение и работа сердца
Строение и работа сердца Всем привет Поговорим о теориях происхождения жизни.
Всем привет Поговорим о теориях происхождения жизни. Теплорегуляция Интегрированный урок (физики и биологии)
Теплорегуляция Интегрированный урок (физики и биологии) Гены развития дрозофилы
Гены развития дрозофилы Презентация Полевые сорняки
Презентация Полевые сорняки Влияние породы коров на физико-химичесский состав молока и качество сливочного масла. Оценка племенных животных. Мечение скота
Влияние породы коров на физико-химичесский состав молока и качество сливочного масла. Оценка племенных животных. Мечение скота Природа вокруг нас
Природа вокруг нас Гены в хромосомах и популяциях
Гены в хромосомах и популяциях Презентация на тему «Лекарственные и ядовитые растения» Презентацию подготовила ученица 6 А класса МОУ-СОШ № 33 Резнеченко Ангел
Презентация на тему «Лекарственные и ядовитые растения» Презентацию подготовила ученица 6 А класса МОУ-СОШ № 33 Резнеченко Ангел Споры и Спорангии
Споры и Спорангии Презентация на тему "Семейство Крестоцветные" - скачать презентации по Биологии
Презентация на тему "Семейство Крестоцветные" - скачать презентации по Биологии Пищеварительный канал
Пищеварительный канал Селекция микроорганизмов
Селекция микроорганизмов Международный день птиц
Международный день птиц Рани. Їх класифікація. Ярової М. Авак’ян О.
Рани. Їх класифікація. Ярової М. Авак’ян О.  Генетика пола. Наследование, сцепленное с полом
Генетика пола. Наследование, сцепленное с полом История развития, основные достижения и проблемы медицинской генетики. Цитологические основы наследственности
История развития, основные достижения и проблемы медицинской генетики. Цитологические основы наследственности Презентация на тему Ежи морские (Echinoidea)
Презентация на тему Ежи морские (Echinoidea)  Мутагенные факторы
Мутагенные факторы Взаимоотношения между организмами хищничество
Взаимоотношения между организмами хищничество Выполнил: учитель биологии МБОУ ООШ п.Туголесский Бор Солдакова Марина Александровна
Выполнил: учитель биологии МБОУ ООШ п.Туголесский Бор Солдакова Марина Александровна