Содержание
- 2. С пищей в сутки поступает около 100 г белков; Расщепление белков в процессе пищеварения происходит под
- 3. Бόльшая часть аминокислот используется для синтеза белков; Помимо синтеза белков аминокислоты еще используются для синтеза различных
- 4. Часть аминокислот подвергается распаду и превращаются в конечные продукты: CO2, H2O и NH3; Распад начинается с
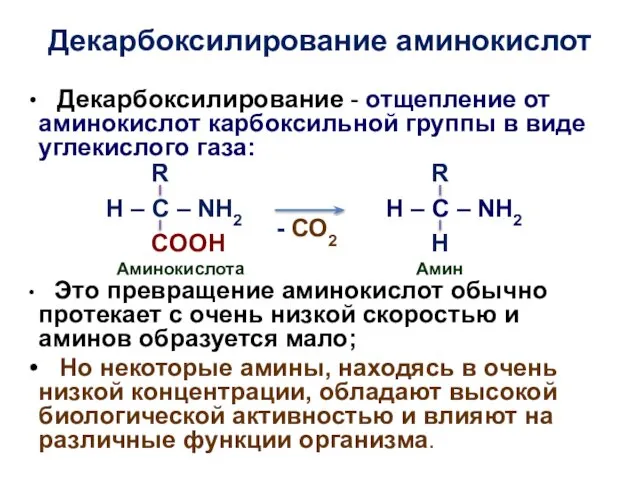
- 5. Декарбоксилирование аминокислот Декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа: Это превращение аминокислот
- 6. Очень активным биогенным амином является гистамин, образующийся при декарбоксилировании аминокислоты гистидина; Биологическая активность гистамина проявляется в
- 7. Однако серьезной опасности для организма биогенные амины не представляют, так как в организме имеются ферменты, разрушающие
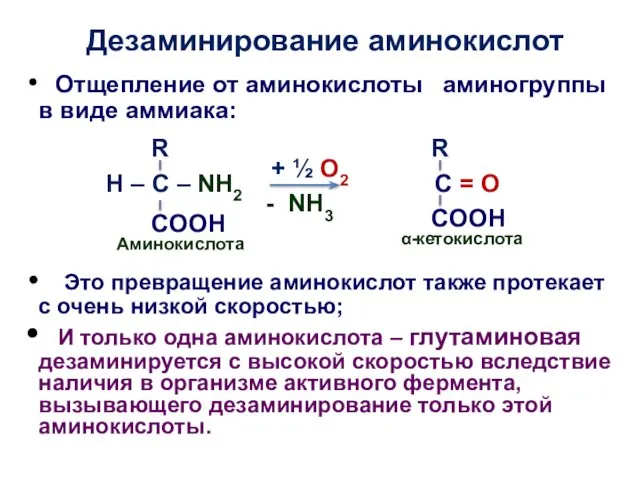
- 8. Дезаминирование аминокислот Отщепление от аминокислоты аминогруппы в виде аммиака: Это превращение аминокислот также протекает с очень
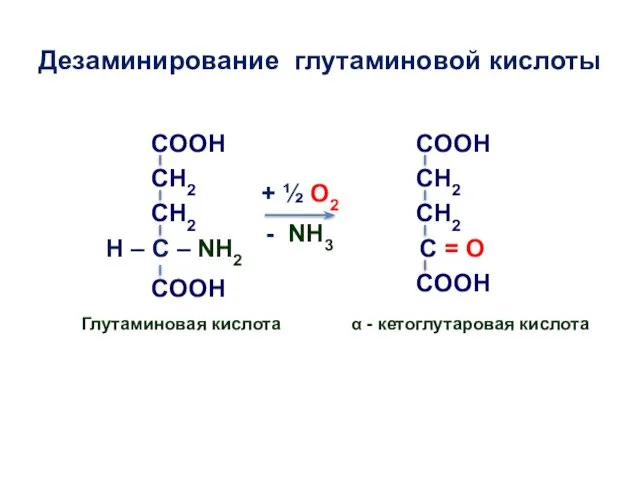
- 9. Дезаминирование глутаминовой кислоты H – C – NH2 COOH C = O Глутаминовая кислота - NH3
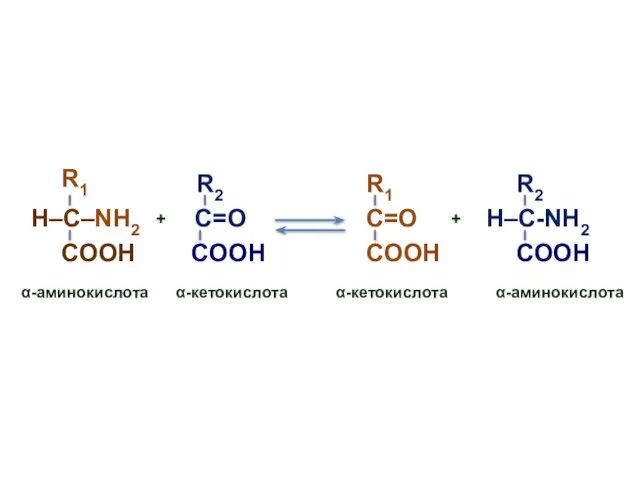
- 10. Трансаминирование (переаминирование) Реакция между аминокислотами и α-кетокислотами; В ходе этой реакции ее участники обмениваются функциональными группами,
- 11. R1 R2 H–C–NH2 COOH α-аминокислота COOH C=О C=О H–C-NH2 + R1 R2 COOH COOH + α-кетокислота
- 12. Трансаминированию подвергаются все аминокислоты; В этой реакции участвует кофермент - фосфопиридоксаль, для образования которого необходим витамин
- 13. Трансаминирование выполняет две основные функции: а) За счет трансаминирования одни аминокислоты могут превращаться в другие; При
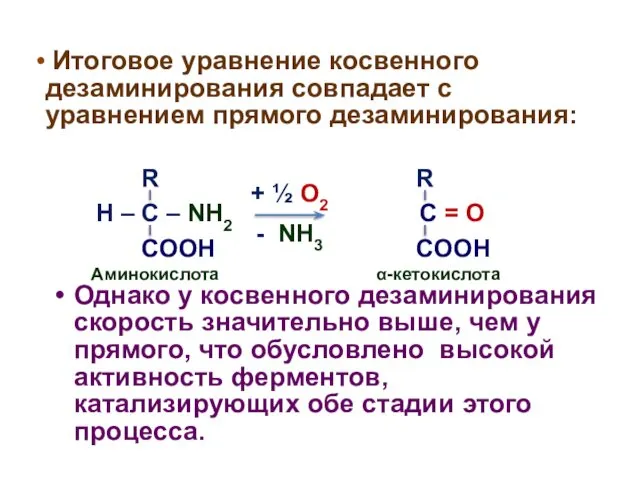
- 14. б) Трансаминирование является составной частью косвенного (непрямого) дезаминирования аминокислот - процесса, с которого начинается распад большинства
- 15. Схема косвенного дезаминирования
- 16. . R R H – C – NH2 COOH C = O Аминокислота - NH3 +
- 17. Образовавшиеся α-кетокислоты далее подвергаются глубокому распаду и превращаются в конечные продукты CO2 и H2O; Для каждой
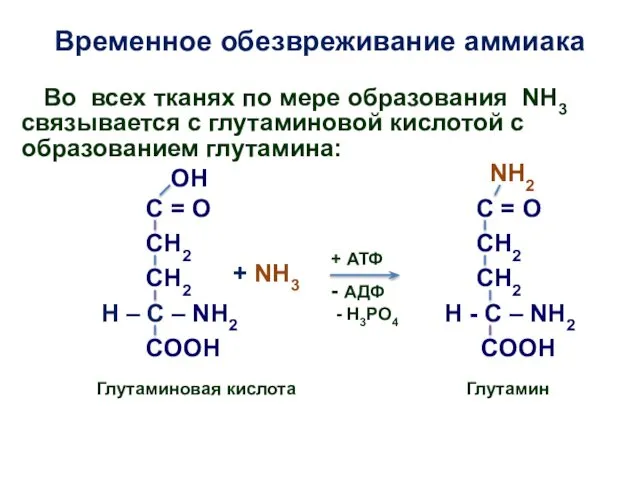
- 18. Второй продукт косвенного дезаминирования аминокислот – аммиак; Для организма аммиак является высоко токсичным; Поэтому в организме
- 19. Временное обезвреживание аммиака ОН H – C – NH2 COOH H - C – NH2 Глутаминовая
- 20. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и NH3; Образовавшаяся
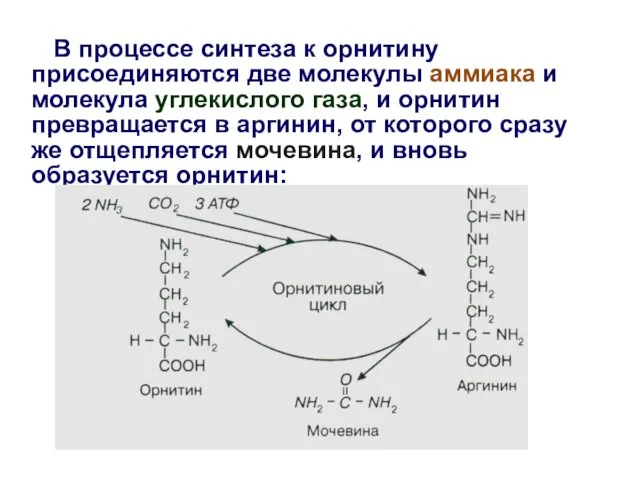
- 21. Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии; В синтезе мочевины очень важное участие
- 22. В процессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается
- 23. Синтез мочевины – это окончательное обезвреживание аммиака; . Из печени с кровью мочевина поступает в почки
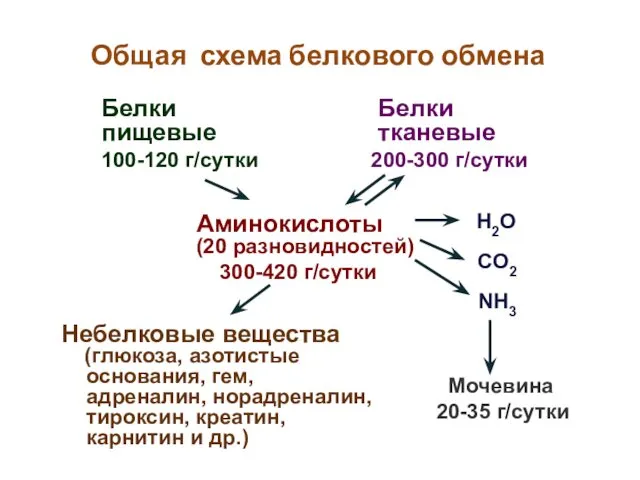
- 24. Общая схема белкового обмена Белки пищевые 100-120 г/сутки Белки тканевые 200-300 г/сутки Аминокислоты (20 разновидностей) 300-420
- 25. Тест 1 Основным превращением аминокислот в организме является реакция: а) дезаминирования б) декарбоксилирования в) изомеризации г)
- 26. Тест 2 В организме дезаминированию преимущественно подвергается аминокислота: а) аланин б) глицин в) глутаминовая кислота г)
- 27. Тест 3 При декарбоксилировании аминокислот образуется: а) аммиак б) ацетон в) лактат г) углекислый газ
- 28. Тест 4 В процессе трансаминирования аминогруппа переносится: а) от амина на аминокислоту б) от амина на
- 29. Тест 5 При трансаминировании аминокислоты превращаются: а) в жирные кислоты б) в кетокислоты в) в молочную
- 30. Тест 6 Биогенные амины в организме образуются в реакции: а) дезаминирования б) декарбоксилирования в) изомеризации г)
- 31. Тест 7 Углекислый газ при распаде аминокислот образуется путем: а) дезаминирования б) декарбоксилирования в) окисления г)
- 32. Тест 8 Аммиак образуется при дезаминировании: а) аминокислот б) ацетил-КоА в) кетокислот г) кетоновых тел
- 33. Тест 9 При временном обезвреживании аммиака образуется: а) глутамин б) глутаминовая кислота в) мочевая кислота г)
- 34. Тест 10 Специфическим продуктом распада белков является: а) ацетоуксусная кислота б) молочная кислота в) мочевая кислота
- 36. Скачать презентацию

























 Введение в биологию
Введение в биологию Тип Mollusca. Строение моллюсков классов Gastropoda и Cephalopoda
Тип Mollusca. Строение моллюсков классов Gastropoda и Cephalopoda Животные Африки
Животные Африки Плесневые грибы и дрожжи Питание Размножение Значение в природе
Плесневые грибы и дрожжи Питание Размножение Значение в природе  Панголиные. Классификация
Панголиные. Классификация Мухи и меры борьбы с ними
Мухи и меры борьбы с ними Презентация на тему "Хвостатые" - скачать презентации по Биологии
Презентация на тему "Хвостатые" - скачать презентации по Биологии I закон Менделя Закон доминирования: «При скрещивании двух гомозиготных организмов, отличающихся по альтернативным вариантам
I закон Менделя Закон доминирования: «При скрещивании двух гомозиготных организмов, отличающихся по альтернативным вариантам РЕФЛЕКСИВНО – ДЕЛОВАЯ ИГРА РЕФЛЕКСИВНО – ДЕЛОВАЯ ИГРА ПО БИОЛОГИИ «ЦИТОЛОГИЯ. МОЛЕКУЛЯРНЫЕ ОСНОВЫ НАСЛЕДСТВЕННОСТИ» Подго
РЕФЛЕКСИВНО – ДЕЛОВАЯ ИГРА РЕФЛЕКСИВНО – ДЕЛОВАЯ ИГРА ПО БИОЛОГИИ «ЦИТОЛОГИЯ. МОЛЕКУЛЯРНЫЕ ОСНОВЫ НАСЛЕДСТВЕННОСТИ» Подго Понятие биогеоценоза
Понятие биогеоценоза Тип членистоногие. Классы ракообразных, паукообразных, насекомых
Тип членистоногие. Классы ракообразных, паукообразных, насекомых Метаболизм углеводов
Метаболизм углеводов БИОЛОГИЯ 7 КЛАСС раздел «Животные» темы «Птицы» и «Млекопитающие» - по 5 уроков Разработка 10 уроков с использованием компьютера Л
БИОЛОГИЯ 7 КЛАСС раздел «Животные» темы «Птицы» и «Млекопитающие» - по 5 уроков Разработка 10 уроков с использованием компьютера Л Возникновение жизни на Земле
Возникновение жизни на Земле Класс Аскомицеты или сумчатые грибы
Класс Аскомицеты или сумчатые грибы Віруси, пріони
Віруси, пріони Животный мир. Антарктида
Животный мир. Антарктида Родина Складноцвіті
Родина Складноцвіті Биогенные d-элементы
Биогенные d-элементы Пластический обмен. Синтез белка
Пластический обмен. Синтез белка :Балықтар дүниесінің ерекшеліктерін, маңызын, қызметін, құрылысын түсіндіру
:Балықтар дүниесінің ерекшеліктерін, маңызын, қызметін, құрылысын түсіндіру Пурины. Строение пурина. (Лекция 9)
Пурины. Строение пурина. (Лекция 9) СВЕТ КАК ЭКОЛОГИЧЕСКИЙ ФАКТОР
СВЕТ КАК ЭКОЛОГИЧЕСКИЙ ФАКТОР  Клітина – елементарна одиниця живого. Біомембрани
Клітина – елементарна одиниця живого. Біомембрани Пищеварительная система человека
Пищеварительная система человека Концепции появления живого на земле. (Лекция 10)
Концепции появления живого на земле. (Лекция 10) Мышцы туловища
Мышцы туловища Введение в курс спортивной физиологии. Физиологическая характеристика различных видов мышечной деятельности
Введение в курс спортивной физиологии. Физиологическая характеристика различных видов мышечной деятельности