Содержание
- 2. Атомная и ядерная физика – раздел физики, изучающий строение атома и атомного ядра и процессы, связанные
- 3. Атом – наименьшая частица химического элемента, носитель его свойств. Элементарные частицы – это первичные, неразложимые частицы,
- 4. Строение атома 1 1) Опыт Резерфорда (1906 г)
- 6. 2) Выводы Э. Резерфорда Ученому понадобилось несколько лет, чтобы понять столь неожиданное рассеяние α-частиц на большие
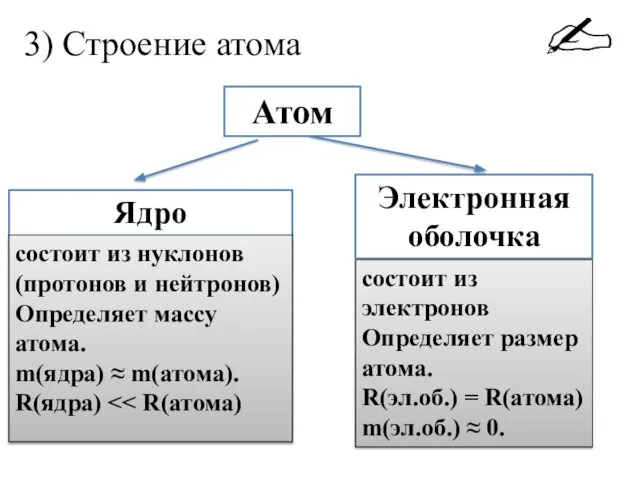
- 7. 3) Строение атома Атом Ядро Электронная оболочка состоит из нуклонов (протонов и нейтронов) Определяет массу атома.
- 8. Состав атома Атомы химических элементов состоят из трех частиц: протоны или р+ нейтроны или n0 электроны
- 9. Открытие протона 1913 г. Э.Резерфорд выдвинул гипотезу о том, что одной из частиц, входящих в состав
- 10. Открытие нейтрона 1920 г. Э.Резерфорд предположил существование электрически нейтральной частицы с массой, приблизительно равной массе протона.
- 11. Протонно-нейтронная модель ядра 1932 г. советские ученые Е.Н. Гапон, Д.Д.Иваненко и немецкий физик Гейзенберг Все ядра
- 12. 4) Количественная характеристика атомов А – массовое число атома Z – зарядовое число атома Масса атомов:
- 13. Опишите характеристики и состав атомов Масса атомов: 14 а.е.м. Заряд ядра: + 6 Состав ядра: число
- 14. Задание. С помощью периодической таблицы Менделеева определите состав ядер указанных ниже элементов: Нуклоны – 235 Протоны
- 15. Изотопы Изотопы - это разновидности одного и того же химического элемента, имеющие разную массу ядер. Изотопы
- 16. 2 Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого
- 19. 3
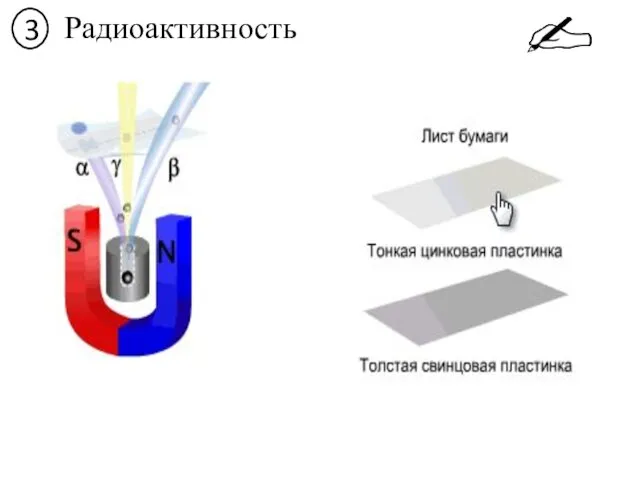
- 20. 3 Радиоактивность
- 21. N – число нераспавшихся ядер в данный момент времени
- 24. Виды радиоактивного распада 4
- 25. 5 Энергия связи атомных ядер
- 26. Физический лабиринт
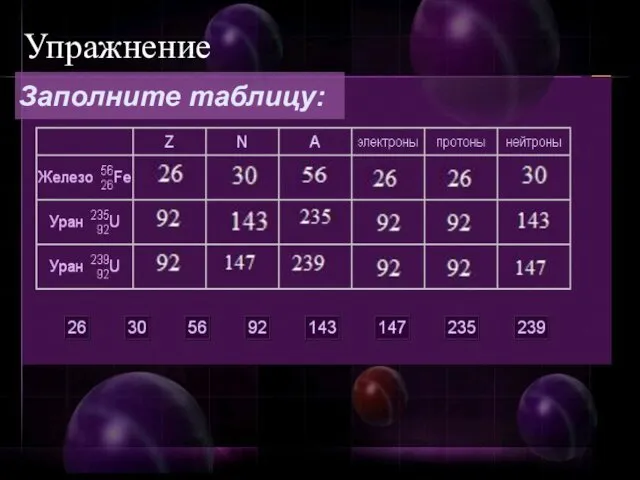
- 27. Упражнение Заполните таблицу:
- 28. Тест: Молекулы Ионы Протоны Электроны Изотопы Нейтроны Из каких частиц состоит атом? Планетарной называется модель строения
- 29. Вставьте недостающие слова: Атомный номер Z говорит нам о числе … , содержащихся в ядре, в
- 30. С помощью периодической таблицы Менделеева определите состав атомов указанных ниже элементов:
- 31. Вычислите приблизительную массу атома платины в атомных единицах массы и в килограммах. 78 а.е.м.=1,295·10-25 кг 117
- 33. Скачать презентацию



























 ТЕМПЕРАТУРА Выполнила: Ученица 9 «Б» класса Кузнецова Алина
ТЕМПЕРАТУРА Выполнила: Ученица 9 «Б» класса Кузнецова Алина Второй закон Ньютона дистанционное обучение
Второй закон Ньютона дистанционное обучение Физические процессы в диэлектриках
Физические процессы в диэлектриках Модернизация топливного участка
Модернизация топливного участка Кинематика точки
Кинематика точки Магнитное поле
Магнитное поле Проектная работа. Маятник (Колыбель) Ньютона
Проектная работа. Маятник (Колыбель) Ньютона Магнитное поле. Магнитные линии
Магнитное поле. Магнитные линии Основные неисправности и техническое обслуживание системы питания карбюраторного двигателя
Основные неисправности и техническое обслуживание системы питания карбюраторного двигателя Импульс тела
Импульс тела Презентация Физические величины и их измерение
Презентация Физические величины и их измерение Презентация по физике "Элементы квантовой механики" - скачать
Презентация по физике "Элементы квантовой механики" - скачать  Атомные спектры
Атомные спектры Некоторые проблемные задачи ЕГЭ по геометрической оптике
Некоторые проблемные задачи ЕГЭ по геометрической оптике Поток энергии. Поток импульса. Сила сопротивления при потенциальном обтекании
Поток энергии. Поток импульса. Сила сопротивления при потенциальном обтекании Дисперсия
Дисперсия Вас приветствует Онькова Ольга Владимировна - учитель физики РМОУ Сокурская СОШ
Вас приветствует Онькова Ольга Владимировна - учитель физики РМОУ Сокурская СОШ Основные понятия электросвязи. Информация, сообщение, сигнал
Основные понятия электросвязи. Информация, сообщение, сигнал Импульс и энергия. (Energy & Momentum)
Импульс и энергия. (Energy & Momentum) Соединение проводников
Соединение проводников Гидрология (Лекция №1)
Гидрология (Лекция №1) Основные понятия и определения. Классификация электрических цепей
Основные понятия и определения. Классификация электрических цепей Свободные и вынужденные электромагнитные колебания
Свободные и вынужденные электромагнитные колебания Стабилитрон тақырыбына арналған презентация
Стабилитрон тақырыбына арналған презентация Теплопроводность через плоскую и цилиндрическую стенки при граничных условиях третьего рода (теплопередача)
Теплопроводность через плоскую и цилиндрическую стенки при граничных условиях третьего рода (теплопередача) Физика. Электростатика (продолжение)
Физика. Электростатика (продолжение)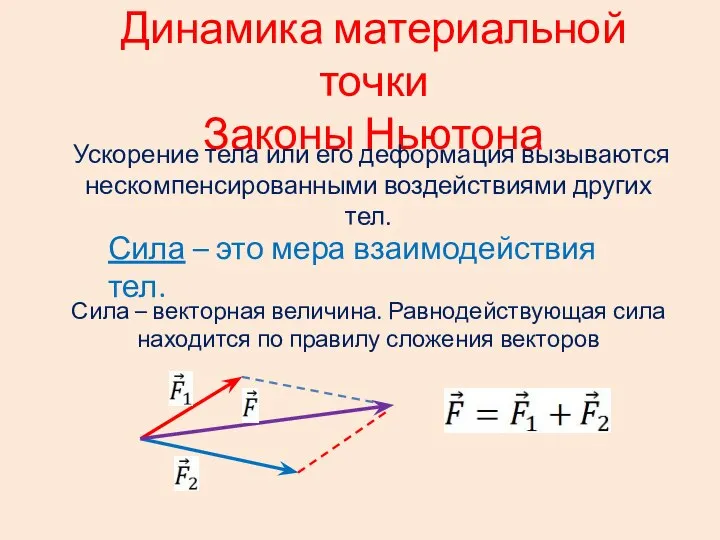 Динамика материальной точки. Законы Ньютона
Динамика материальной точки. Законы Ньютона Аттестационная работа. Образовательная программа внеурочной деятельности Химия и физика с детства. (1-4 класс)
Аттестационная работа. Образовательная программа внеурочной деятельности Химия и физика с детства. (1-4 класс)