Элементы физики твердого тела. Кристаллические и аморфные вещества. Кристаллическая решетка. (Лекция 9)
Содержание
- 2. Элементы физики твёрдого тела Предмет физики твёрдого тела - изучение состава твёрдых тел, их атомно-электронной структуры,
- 3. Кристаллическая решетка - это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки
- 4. Понятие о кристаллической решётке. Элементарная ячейка кристалла (кристаллической решетки) - структурная единица, содержащая как один, так
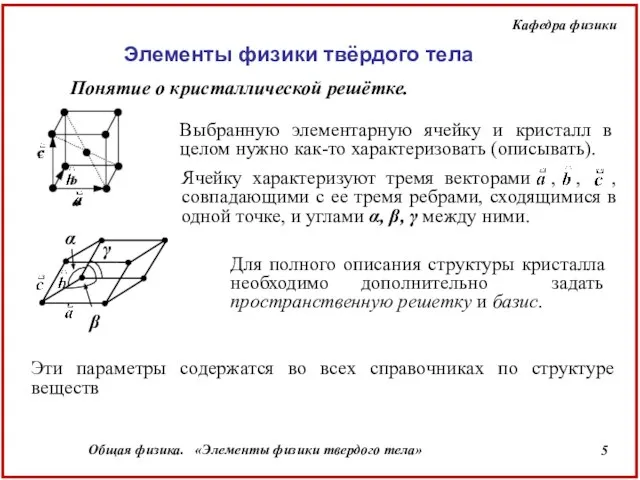
- 5. Понятие о кристаллической решётке. Выбранную элементарную ячейку и кристалл в целом нужно как-то характеризовать (описывать). Для
- 6. В зависимости от углов α, β, γ и соотношения между a, b, c различают 7 кристаллических
- 7. Элементы физики твёрдого тела Виды межатомных связей (типы кристаллов) в твёрдых телах Атомы заставляет объединяться и
- 8. Ионная связь (ионные кристаллы). Взаимодействуют щелочные металлы (K, Na, Li, Rb, Cs, Fr) и галоиды (F,
- 9. Ковалентные кристаллы Это соединения типа H2, O2, N2, C, Si, Ge (последние три имеют решётку типа
- 10. Металлические кристаллы В металлических кристаллах внешние электроны атомов могут свободно перемещаться между ионными остовами. Эти электроны
- 11. Элементы физики твёрдого тела Ван-дер-Ваальсовы кристаллы Такие системы в твёрдом состоянии образуют молекулярные кристаллы. Силы обусловлены
- 13. Скачать презентацию









 Презентация по физике "Лазерные компоненты" - скачать
Презентация по физике "Лазерные компоненты" - скачать  Силы в природе, законы Ньютона
Силы в природе, законы Ньютона Строение атома. Планетарная модель атома
Строение атома. Планетарная модель атома Три состояния вещества. 7 класс
Три состояния вещества. 7 класс Химические реакторы
Химические реакторы Агрегатное состояние вещества. Плавление и отвердевание кристаллических тел
Агрегатное состояние вещества. Плавление и отвердевание кристаллических тел Создание фонтанов
Создание фонтанов Радиоактивность. Проникающая способность радиации. Открытие изотопов
Радиоактивность. Проникающая способность радиации. Открытие изотопов Дисперсия. Интерференция. Дифракция. Учитель физики МОУ СОШ №8 г. Коврова Макашина Татьяна Анатольевна
Дисперсия. Интерференция. Дифракция. Учитель физики МОУ СОШ №8 г. Коврова Макашина Татьяна Анатольевна Изотроп ортадағы жарықтың таралуы, сынуы және шағылуы
Изотроп ортадағы жарықтың таралуы, сынуы және шағылуы Законы Ньютона. (Лекция 3)
Законы Ньютона. (Лекция 3) Види теплопередачі
Види теплопередачі Уравнения Максвелла
Уравнения Максвелла Закон Ома для участка цепи Цель урока: Установить зависимость между силой тока, напряжением на участке цепи и сопротивлением этог
Закон Ома для участка цепи Цель урока: Установить зависимость между силой тока, напряжением на участке цепи и сопротивлением этог Электромагнетизм. Линии напряженности электрического поля
Электромагнетизм. Линии напряженности электрического поля Radiation
Radiation Презентация по физике Модели в механике. Система отчета. Траектория
Презентация по физике Модели в механике. Система отчета. Траектория  Body accessories
Body accessories Линза. Построение изображения в линзе. Формула тонкой линзы
Линза. Построение изображения в линзе. Формула тонкой линзы Падение плоской ЭМВ на границу раздела двух сред
Падение плоской ЭМВ на границу раздела двух сред Лекция 13
Лекция 13  Свойства и применение радиоволн. (11 класс)
Свойства и применение радиоволн. (11 класс) Движение и взаимодействие тел. Взаимодействие тел
Движение и взаимодействие тел. Взаимодействие тел Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим
Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим Презентация по физике Применение аккумуляторов
Презентация по физике Применение аккумуляторов Приборы для измерения давления и их применения
Приборы для измерения давления и их применения Квантовая оптика
Квантовая оптика МИЭМ практика
МИЭМ практика