Содержание
- 2. Энтальпия Өткен ғасырда белгілі физик Гиббс жылу есептеулерінің тәжірибесіне жаңа функция – энтальпияны енгізді, яғни 1
- 3. Егер термодинамикалық жүйеде қайтымды процестер жүрсе жәнеде көлемнің өзгеруі рdv жұмысымен қатар, жүйеніңкөлемінің өзгеруімен байланыссыз және
- 4. Теңдеуінен алынады: немесе Энтальпияның өзгерісі толығымен жұмысшы дененің бастапқы және соңғы күйлерімен анықталады және аралық күйлерге
- 5. Булар, газдар, газ қоспалары үшін энтальпия мәнін техникалық және анықтама әдебиеттерден табуға болады. Осы деректерді қолдана
- 7. Скачать презентацию
Энтальпия
Өткен ғасырда белгілі физик Гиббс жылу есептеулерінің тәжірибесіне жаңа функция
Энтальпия
Өткен ғасырда белгілі физик Гиббс жылу есептеулерінің тәжірибесіне жаңа функция
Меншікті энтальпияға енетін u, р және v шамалары күй параметрлері (функциялары) болатындықтан, энтальпияда күйдің параметрі (функциясы) болады.
Энтальпия аддитивті немесе экстенсивті параметрлерге жатады, өйткені оның шамасы массаға пропорционал.
Егер тәуелсіз параметрлер ретінде қысым р мен температура Т алынса, онда қайтымды процестер үшін термодинамиканың бірінші заңының аналитикалық өрнегінің басқа түрін алуға болады
Осыдан
немесе
Термодинамикалық жүйе энтальпиясының абсолюттік мәнін
теңдеуін интегралдап алуға болады.
Интегралдау нәтижесінде өрнекке і үшін интегралдау тұрақтысы
кіреді:
Егер термодинамикалық жүйеде қайтымды процестер жүрсе жәнеде көлемнің өзгеруі рdv жұмысымен
Егер термодинамикалық жүйеде қайтымды процестер жүрсе жәнеде көлемнің өзгеруі рdv жұмысымен
Теңдеулер термодинамикалық жүйенің күй өзгерістерінің қайтымды процестері үшін термодинамиканың бірінші заңының жалпы аналитикалық өрнегіні болып табылады. р = соnst кезінде теңдеу:
di энтальпияның дифференциалы тұрақты қысым кезіндегі процесте қатысатын жылудың элементарлы мөлшері болады. Қысымның тұрақтылығымен өтетін процесте барлық жылу энтальпияның өзгерісіне шығындалады:
Теңдеуінен алынады: немесе
Энтальпияның өзгерісі толығымен жұмысшы дененің бастапқы және соңғы күйлерімен
Теңдеуінен алынады: немесе
Энтальпияның өзгерісі толығымен жұмысшы дененің бастапқы және соңғы күйлерімен
Энтальпия күйдің негізгі параметрлерінің функциясы болмағандықтан, di газ күйін сипаттайтын кез-келген тәуелсіз ауыспалылар кезінде осы функцияның толық дифференциалы болады
А мен В екі нүктесінің арасында өтетін барлық процестердегі меншікті энтальпияның өзгерісі, бірдей
Булар, газдар, газ қоспалары үшін энтальпия мәнін техникалық және анықтама әдебиеттерден
Булар, газдар, газ қоспалары үшін энтальпия мәнін техникалық және анықтама әдебиеттерден
Энтальпия жылыту және суыту қондырғыларын есептеу кезінде қолданылады және жұмысшы дененің күй параметрі ретінде жылу есептеулерін жеңілдетеді.
Негізгі параметрлер ретінде р және Т қабылданған жағдайда энтальпияны қолдану тиімді. Мұны энтальпияны ішкі энергиямен u салыстыру кезінде көрнекі байқауға болады. V = const кезінде термодинамиканың бірінші заңының теңдеуі немесе түрленеді, p=const кезінде
Идеал газдың энтальпиясы, ішкі энергия сияқты, температураның функциясы болады және басқа параметрлерге тәуелсіз.
Шынында, идеал газ үшін
Демек (екі қосылғашта тек қана температураға тәуелді болғандықтан),
Онда ішкі энергия сияқты, мұндада аламыз
яғни идеал газ күйінің өзгеруінің кез-келген процесінде температура бойынша энтальпияның өзгерісінің туындысы толық туынды болады.




 Решение задач по теме Механические колебания и волны. Звук
Решение задач по теме Механические колебания и волны. Звук Электромагнитные колебания. Закрытый колебательный контур
Электромагнитные колебания. Закрытый колебательный контур Альтернативные источники энергии. Ветровые станции
Альтернативные источники энергии. Ветровые станции Истоирия создания реле. Вклад Дж.Генри
Истоирия создания реле. Вклад Дж.Генри Презентация по физике "Процесс многократного рассеяния" - скачать
Презентация по физике "Процесс многократного рассеяния" - скачать  Сергеева Л. Ф. Профессиональный лицей № 21 Г. Георгиевск
Сергеева Л. Ф. Профессиональный лицей № 21 Г. Георгиевск Задачи по физике
Задачи по физике Механическая работа. Единицы работы
Механическая работа. Единицы работы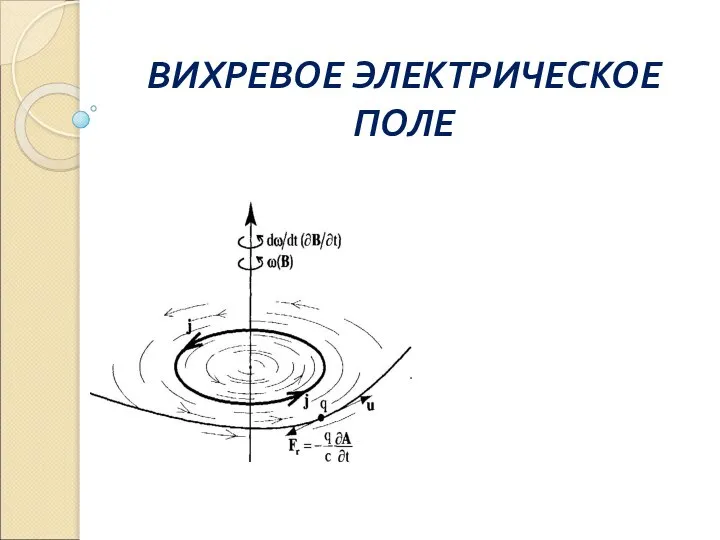 ВИХРЕВОЕ ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
ВИХРЕВОЕ ЭЛЕКТРИЧЕСКОЕ ПОЛЕ  Приборы для измерения давления
Приборы для измерения давления Электрическая ёмкость проводника. Единица электроёмкости. Конденсатор. Ёмкость плоского конденсатора
Электрическая ёмкость проводника. Единица электроёмкости. Конденсатор. Ёмкость плоского конденсатора Электролиз. История создания. Применение
Электролиз. История создания. Применение Лекции по физике. Молекулярная физика и основы термодинамики
Лекции по физике. Молекулярная физика и основы термодинамики Аттестационная работа. Организация исследовательской деятельности обучающихся по физике Главное не табличка, а привычка
Аттестационная работа. Организация исследовательской деятельности обучающихся по физике Главное не табличка, а привычка Полное отражение света 11 класс - Презентация_
Полное отражение света 11 класс - Презентация_ Схемы электрических соединений на стороне 35 кВ и выше. (Лекция 13)
Схемы электрических соединений на стороне 35 кВ и выше. (Лекция 13) Презентация по физике "Ядерна зброя" - скачать бесплатно
Презентация по физике "Ядерна зброя" - скачать бесплатно Источники энергии. Тепловые двигатели
Источники энергии. Тепловые двигатели Ионные двигатели схемы Кауфмана, двигатели NSTAR, NEXT, NEXIS, T-6
Ионные двигатели схемы Кауфмана, двигатели NSTAR, NEXT, NEXIS, T-6 «Электродинамика» бөлімі бойынша оқу материалын қайталау, қорытындылау және жүйелеу
«Электродинамика» бөлімі бойынша оқу материалын қайталау, қорытындылау және жүйелеу Светотехнические величины
Светотехнические величины Презентация по физике "Путешествие по стране Электрония" - скачать
Презентация по физике "Путешествие по стране Электрония" - скачать  Физика ядерных реакторов
Физика ядерных реакторов Автор работы: Камскова Екатерина Автор работы: Камскова Екатерина МОУ СОШ №6, 9Б класс
Автор работы: Камскова Екатерина Автор работы: Камскова Екатерина МОУ СОШ №6, 9Б класс Элементы квантовой механики
Элементы квантовой механики Технологическая подготовка производства держателя измерителя для условий СНО Машиностроитель
Технологическая подготовка производства держателя измерителя для условий СНО Машиностроитель Презентация по физике "«Легенда о законе Архимеда»" - скачать
Презентация по физике "«Легенда о законе Архимеда»" - скачать  Закон сохранения энергии в механике
Закон сохранения энергии в механике