Содержание
- 2. Интенсивность химического процесса оценивается удельной производительностью, под которой понимают съём целевого продукта в единицу времени с
- 3. Уравнение скорости процесса в самом общем виде имеет вид: W = k ∙ ΔC ∙ Fуд
- 4. Константа скорости процесса. Влияние температуры.
- 5. Константа скорости процесса является сложной величиной, зависящей от химических свойств реагирующих веществ, показателей тепло- и массообмена,
- 6. Рассмотрим более подробно влияние температуры на скорость химического процесса
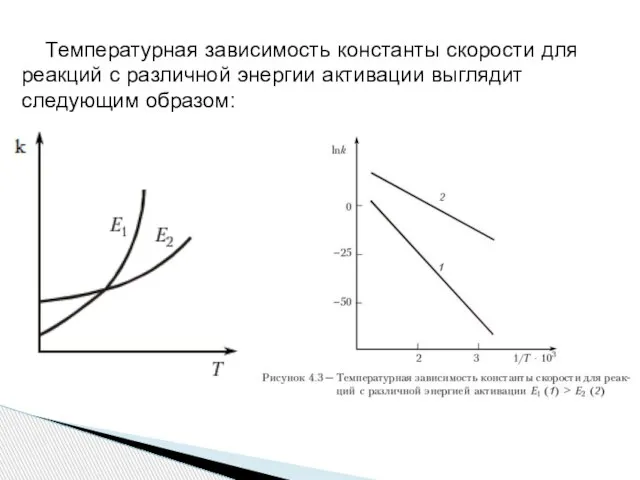
- 8. Температурная зависимость константы скорости для реакций с различной энергии активации выглядит следующим образом:
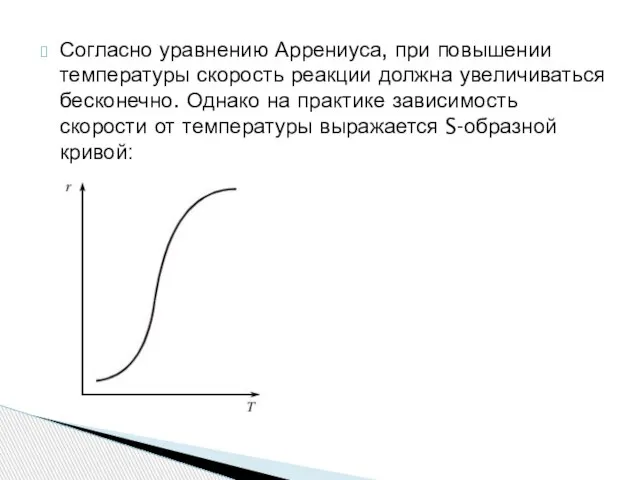
- 9. Согласно уравнению Аррениуса, при повышении температуры скорость реакции должна увеличиваться бесконечно. Однако на практике зависимость скорости
- 10. При очень высоких температурах реагенты расходуются настолько быстро, что просто не успевают прийти в реакционную зону.
- 13. В процессах с диффузионным режимом для ускорения массообмена используют интенсивное перемешивание. В результате этого молекулярная диффузия
- 14. Зависимость константы скорости реакции (1) и коэффициента диффузии (2) от температуры выглядит следующим образом:
- 15. Для всех обратимых экзотермических реакций с увеличением температуры уменьшается величина Kр и равновесный выход продукта. При
- 16. В этом случае зависимость r(T) носит экстремальный характер:
- 17. Высокая скорость процесса достигается при низкой конверсии; Большая степень превращения достигается при низкой скорости процесса. Для
- 18. Для обратимой экзотермической реакции по мере протекания процесса ( увеличения x) непрерывно снижают температуру. В этом
- 19. Для эндотермических процессов высокие температуры более благоприятны. С повышением температуры растет и константа скорости и константа
- 20. Для эндотермических реакций температурная зависимость скорости реакции и конверсии имеет вид:
- 21. В ряде процессов, особенно в технологии органических веществ, повышение температуры ограничивается возникновением побочных реакций с большим
- 25. Удаление реагирующих веществ за счет десорбции из жидкой среды; Спекание зерен катализатора в агломераты, приводящее к
- 26. Регулирование температуры процессов необходимо для увеличения константы скорости процесса k и движущей силы ΔC. Оптимальные температуры
- 28. Скачать презентацию























 Презентация по физике "Лазерные компоненты" - скачать
Презентация по физике "Лазерные компоненты" - скачать  Силы в природе, законы Ньютона
Силы в природе, законы Ньютона Строение атома. Планетарная модель атома
Строение атома. Планетарная модель атома Три состояния вещества. 7 класс
Три состояния вещества. 7 класс Химические реакторы
Химические реакторы Агрегатное состояние вещества. Плавление и отвердевание кристаллических тел
Агрегатное состояние вещества. Плавление и отвердевание кристаллических тел Создание фонтанов
Создание фонтанов Радиоактивность. Проникающая способность радиации. Открытие изотопов
Радиоактивность. Проникающая способность радиации. Открытие изотопов Дисперсия. Интерференция. Дифракция. Учитель физики МОУ СОШ №8 г. Коврова Макашина Татьяна Анатольевна
Дисперсия. Интерференция. Дифракция. Учитель физики МОУ СОШ №8 г. Коврова Макашина Татьяна Анатольевна Изотроп ортадағы жарықтың таралуы, сынуы және шағылуы
Изотроп ортадағы жарықтың таралуы, сынуы және шағылуы Законы Ньютона. (Лекция 3)
Законы Ньютона. (Лекция 3) Види теплопередачі
Види теплопередачі Уравнения Максвелла
Уравнения Максвелла Закон Ома для участка цепи Цель урока: Установить зависимость между силой тока, напряжением на участке цепи и сопротивлением этог
Закон Ома для участка цепи Цель урока: Установить зависимость между силой тока, напряжением на участке цепи и сопротивлением этог Электромагнетизм. Линии напряженности электрического поля
Электромагнетизм. Линии напряженности электрического поля Radiation
Radiation Презентация по физике Модели в механике. Система отчета. Траектория
Презентация по физике Модели в механике. Система отчета. Траектория  Body accessories
Body accessories Линза. Построение изображения в линзе. Формула тонкой линзы
Линза. Построение изображения в линзе. Формула тонкой линзы Падение плоской ЭМВ на границу раздела двух сред
Падение плоской ЭМВ на границу раздела двух сред Лекция 13
Лекция 13  Свойства и применение радиоволн. (11 класс)
Свойства и применение радиоволн. (11 класс) Движение и взаимодействие тел. Взаимодействие тел
Движение и взаимодействие тел. Взаимодействие тел Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим
Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим Презентация по физике Применение аккумуляторов
Презентация по физике Применение аккумуляторов Приборы для измерения давления и их применения
Приборы для измерения давления и их применения Квантовая оптика
Квантовая оптика МИЭМ практика
МИЭМ практика