Содержание
- 2. М.П. Сарина. Механика, молекулярная физика и термодинамика. Молекулярная физика и термодинамика
- 3. Кинетическая теория идеальных газов Изучаются системы, состоящие из большого числа частиц Законы поведения большого числа частиц
- 4. Идеальный газ Молекулы идеального газа –материальные точки Молекулы движутся хаотично Между столкновениями движение равномерное и прямолинейное
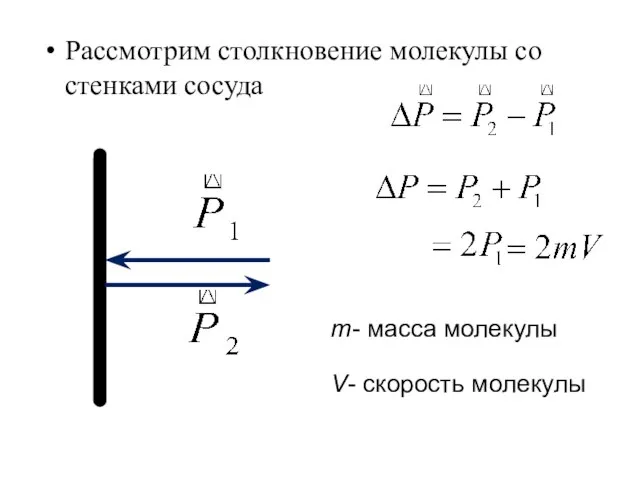
- 5. Рассмотрим столкновение молекулы со стенками сосуда m- масса молекулы V- скорость молекулы
- 6. Давление
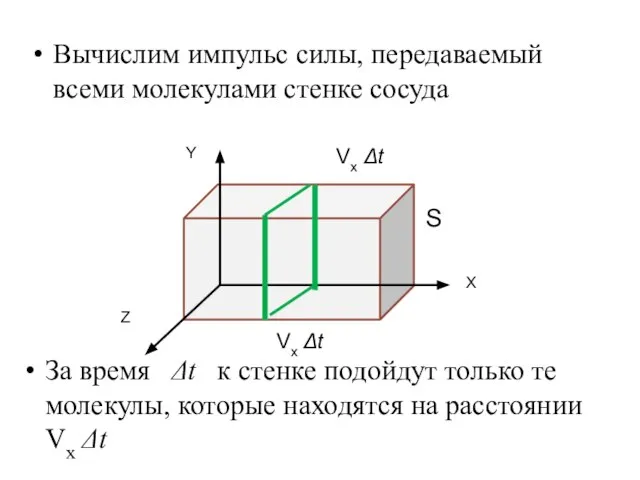
- 7. Вычислим импульс силы, передаваемый всеми молекулами стенке сосуда Z Х Y За время Δt к стенке
- 8. Вычислим количество молекул (N), которые ударятся о стенку за время Δt Концентрация (n) – количество молекул
- 9. Каждая молекула передает стенке импульс Все молекулы передают импульс
- 10. Давление, оказываемое на стенку
- 11. Если в газе содержится N молекул, движущихся со скоростями V1, V2,V3…, то рассматривается средняя квадратичная скорость
- 12. Основное уравнение молекулярно-кинетической теории
- 14. ТЕМПЕРАТУРА Температура – величина, характеризующая тепловое равновесие Особенности 1) температура не аддитивна 2) температурную шкалу можно
- 15. Выбирают 2 реперные точки (температура кипения воды и таяния льда) и делят этот интервал на 100
- 16. Шкала Кельвина Шкала Цельсия
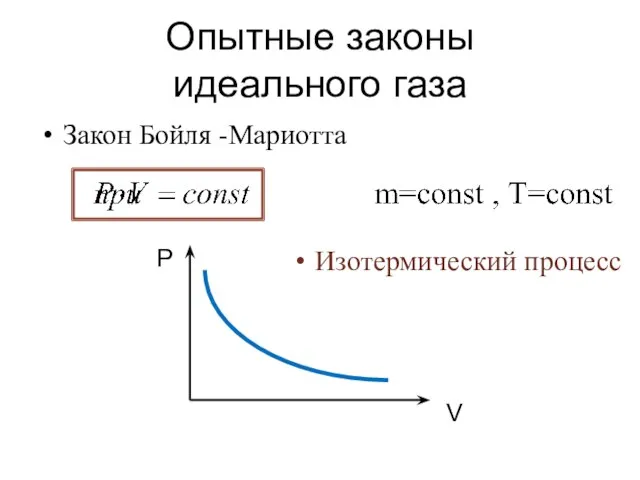
- 18. Опытные законы идеального газа Закон Бойля -Мариотта P V Изотермический процесс
- 19. Закон Гей-Люссака P V Изобарический процесс
- 20. P V Изохорический процесс
- 21. Закон Авогадро При одинаковом давлении и температуре в равных объемах газов содержится одинаковое количество молекул В
- 22. Закон Дальтона Давление смеси газов равно сумме парциальных давлений Парциальное давление – давление , которое производил
- 23. Уравнение Клапейрона –Менделеева (уравнение состояния идеального газа) m- масса газа R= 8,31 Дж/(моль·К) - универсальная газовая
- 24. Для 1 моля k- постоянная Больцмана N- количество молекул
- 25. Число степеней свободы Число степеней свободы- количество независимых переменных, полностью определяющих положение системы в пространстве
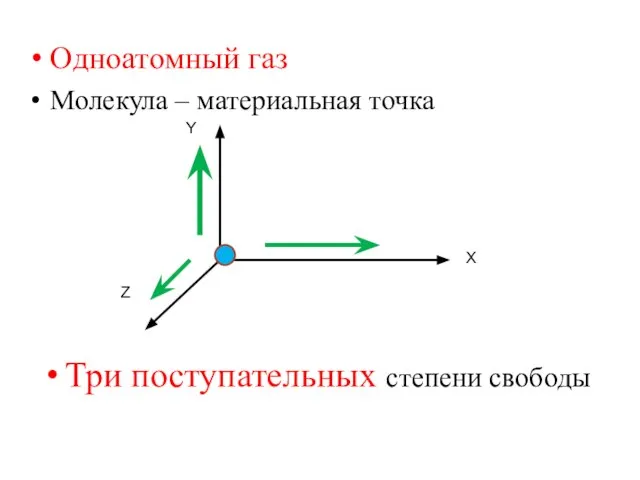
- 26. Одноатомный газ Молекула – материальная точка Z Х Y Три поступательных степени свободы
- 27. Двухатомный газ Z Х Y Три поступательных степени свободы Две вращательных степени свободы
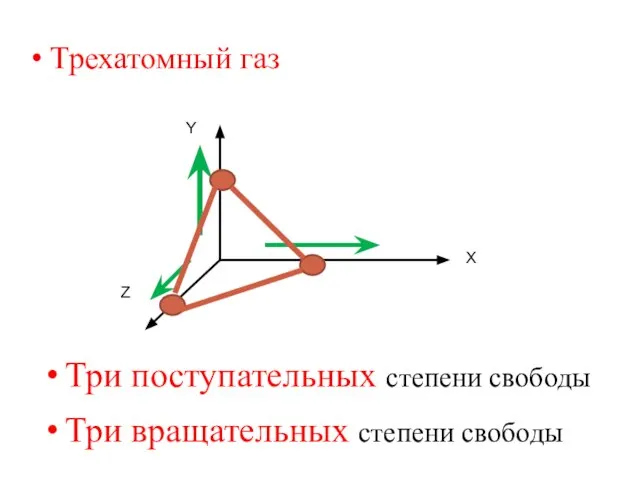
- 28. Трехатомный газ Z Х Y Три поступательных степени свободы Три вращательных степени свободы
- 29. Для реальных молекул необходимо учитывать колебательные степени свободы
- 31. Закон равномерного распределения энергии по степеням свободы Для системы, находящейся в тепловом равновесии на каждую поступательную
- 33. Скачать презентацию






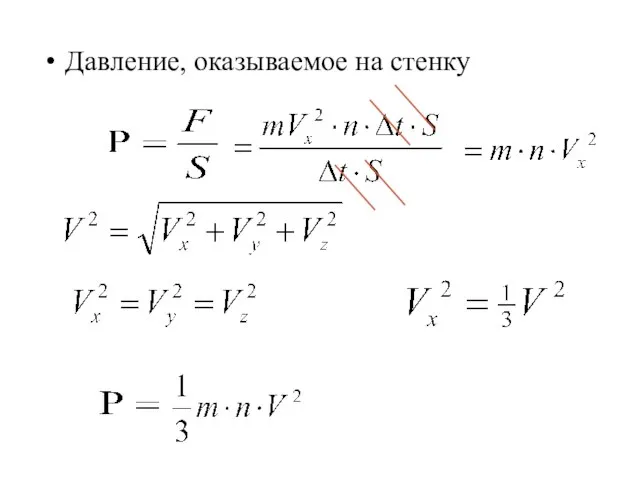


















 НОВЫЕ ПРЕОБРАЗОВАНИЯ ДЛЯ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ Томский политехнический университет г. Томск
НОВЫЕ ПРЕОБРАЗОВАНИЯ ДЛЯ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ Томский политехнический университет г. Томск  Факторы, повышающие интенсивность химического процесса
Факторы, повышающие интенсивность химического процесса В мире звука МОУ «Средняя общеобразовательная школа №3» Выполнила ученица 9 «А» класса Лапкина Ирина. Балахна 2009 год
В мире звука МОУ «Средняя общеобразовательная школа №3» Выполнила ученица 9 «А» класса Лапкина Ирина. Балахна 2009 год Телескоп
Телескоп Ближнепольная оптическая спектроскопия
Ближнепольная оптическая спектроскопия Зубчатые передачи
Зубчатые передачи Биологиялық жүйелер
Биологиялық жүйелер Термодинамическая система
Термодинамическая система Планетарная модель атома. Ядерная модель атома. Квантовые постулаты Бора
Планетарная модель атома. Ядерная модель атома. Квантовые постулаты Бора Дифракция света
Дифракция света  Электрическое поле. Напряженность и потенциал электрического поля
Электрическое поле. Напряженность и потенциал электрического поля Моделирование элементов протонной радиографической установки в среде Geant4
Моделирование элементов протонной радиографической установки в среде Geant4 Тепловые двигатели и их влияние на окружающую среду
Тепловые двигатели и их влияние на окружающую среду Гипотеза де Бройля. Дифракция электронов. Микрочастица в двухщелевом интерферометре. Соотношение неопределенностей Гейзенберга
Гипотеза де Бройля. Дифракция электронов. Микрочастица в двухщелевом интерферометре. Соотношение неопределенностей Гейзенберга Геометрическая оптика. Линзы
Геометрическая оптика. Линзы Лазеры и их применение
Лазеры и их применение Презентация по физике Курс лекции по физике
Презентация по физике Курс лекции по физике  Диагностика цилиндропоршневой группы двигателя
Диагностика цилиндропоршневой группы двигателя Телескопи, рефрактори та рефлектори
Телескопи, рефрактори та рефлектори Свет. Оптика . Оптические явления
Свет. Оптика . Оптические явления Интерференция и дифракция
Интерференция и дифракция Свободные и вынужденные колебания. Резонанс
Свободные и вынужденные колебания. Резонанс Динамика вращательного движения. (Лекция 5)
Динамика вращательного движения. (Лекция 5) Петрофизика. Неоднородность, дисперсность и межфазная поверхность пород
Петрофизика. Неоднородность, дисперсность и межфазная поверхность пород Слесарная мастерская
Слесарная мастерская Физика ядерных реакторов
Физика ядерных реакторов Автор: Васильева Е.Д.
Автор: Васильева Е.Д.  The second law of thermodynamics
The second law of thermodynamics