Содержание
- 2. Тема 4.3 Кинетика химических превращений: Схема превращения; Скорость превращения и скорость реакции; Кинетическое уравнение реакции.
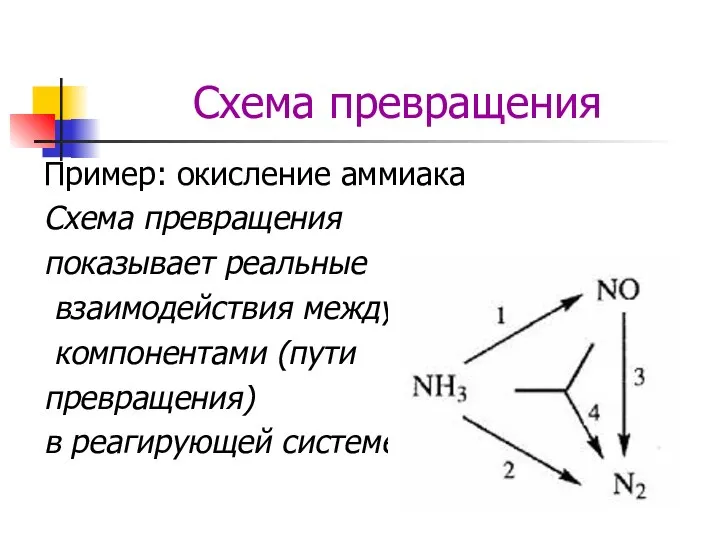
- 3. Схема превращения Пример: окисление аммиака Стехиометрически независимые уравнения 4NH3 + 5O2 = 4NO + 6H2O 4NH3
- 4. Схема превращения Пример: окисление аммиака Действительные превращения 4NH3 + 5O2 = 4NO + 6H2O 4NH3 +
- 5. Схема превращения Пример: окисление аммиака Схема превращения показывает реальные взаимодействия между компонентами (пути превращения) в реагирующей
- 6. Скорость превращения и скорость реакции Скорость превращения вещества — изменение количества компонента реакционной смеси за единицу
- 7. Скорость превращения и скорость реакции Для скоростей превращения различных компонентов реакции νАА + νВВ + …=
- 8. Скорость превращения и скорость реакции Истинная или мгновенная скорость реакции - скорость, определяемая за бесконечно малый
- 9. Скорость превращения и скорость реакции Например, реакция синтеза аммиака N2 + 3H2 = 2NH3 0,5N2 +
- 10. Кинетическое уравнение реакции Зависимость скорости превращения или скорости реакции от условий ее протекания называют кинетическим уравнением
- 11. Скорость превращения и скорость реакции Параметры химической реакции – константы кинетического уравнения, зависящие от свойств реагирующих
- 12. Скорость превращения и скорость реакции Кинетическое уравнение в общем виде Совокупность таких уравнений для всех ключевых
- 13. Скорость превращения и скорость реакции νАА + νВВ + …= νRR +νSS +… Кинетическое уравнение простой
- 14. Скорость превращения и скорость реакции Порядок реакции по реагенту – параметр реакции, показывающий, как скорость реакции
- 15. Скорость превращения и скорость реакции
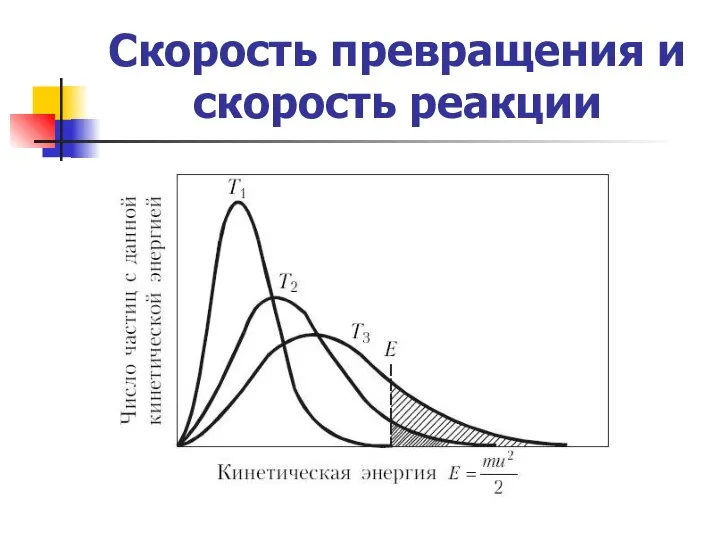
- 16. Скорость превращения и скорость реакции Энергия активации элементарной реакции Е – минимальный избыток энергии над средней
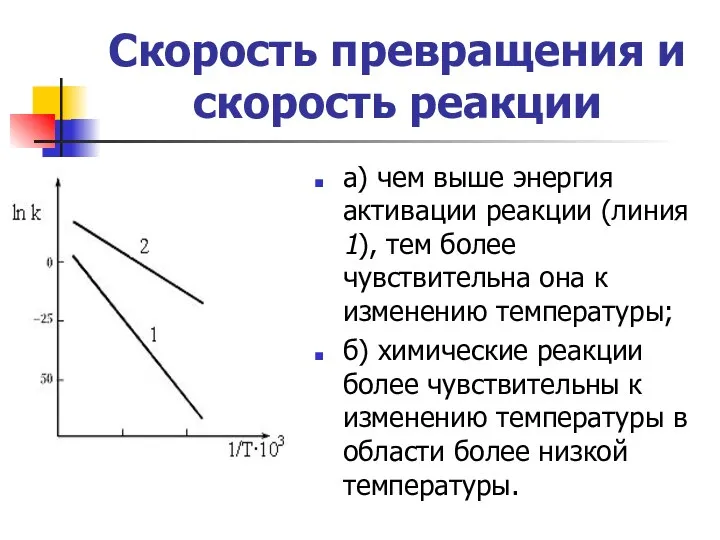
- 17. Скорость превращения и скорость реакции а) чем выше энергия активации реакции (линия 1), тем более чувствительна
- 18. Скорость превращения и скорость реакции Для ориентировочной оценки влияния температуры на скорость реакции можно пользоваться правилом
- 19. Скорость превращения и скорость реакции Кинетическое уравнение простой обратимой реакции
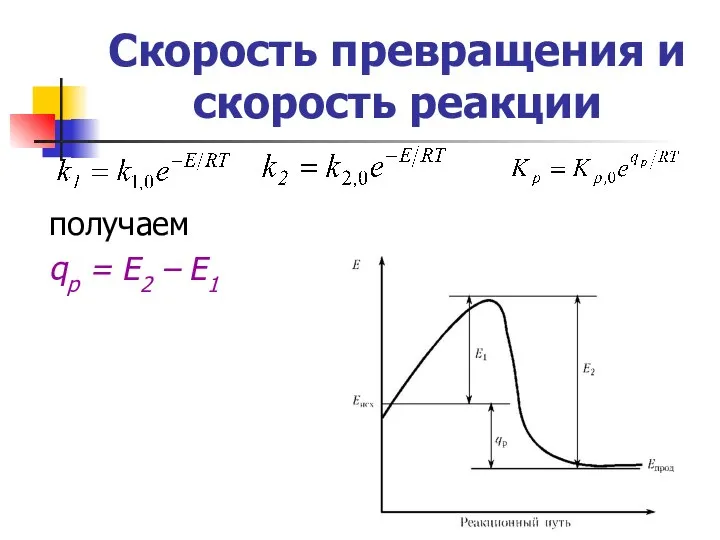
- 20. Скорость превращения и скорость реакции получаем qр = Е2 – Е1
- 22. Скачать презентацию















 Электричество и магнетизм
Электричество и магнетизм Исследовательский проект «Завтрак с физикой» Автор: учащийся 10 «А» класса МОУ сош №3
Исследовательский проект «Завтрак с физикой» Автор: учащийся 10 «А» класса МОУ сош №3  Лекция 1. Кинематика
Лекция 1. Кинематика Проект по физике «Лабораторные работы по физике за курс 7-9 класса»
Проект по физике «Лабораторные работы по физике за курс 7-9 класса»  Детали механизмов и машин. Червячная передача
Детали механизмов и машин. Червячная передача Агрегатные состояния веществ
Агрегатные состояния веществ Теоретическая механика
Теоретическая механика Магнитное поле. Вектор магнитной индукции
Магнитное поле. Вектор магнитной индукции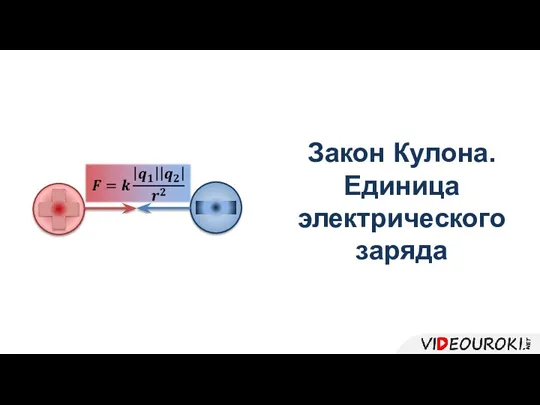 Закон Кулона. Единица электрического заряда
Закон Кулона. Единица электрического заряда Применение радиоактивных изотопов в археологии
Применение радиоактивных изотопов в археологии Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10)
Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10) Атомное ядро
Атомное ядро Баллистика и аэродинамика
Баллистика и аэродинамика Работа по перемещению заряда в электростатическом поле. Теорема о циркуляции вектора
Работа по перемещению заряда в электростатическом поле. Теорема о циркуляции вектора Великие открытия М. В. Ломоносова в физике. МБОУ СОШ №1
Великие открытия М. В. Ломоносова в физике. МБОУ СОШ №1 На чем основано воздухоплавание
На чем основано воздухоплавание Internal combustion engine
Internal combustion engine Робототехника
Робототехника Презентация по физике "Електричне коло" - скачать
Презентация по физике "Електричне коло" - скачать  Опыт Эрнеста Резерфорда 1871 - 1937
Опыт Эрнеста Резерфорда 1871 - 1937 Импульс материальной точки. Другая формулировка второго закона Ньютона. Реактивное движение
Импульс материальной точки. Другая формулировка второго закона Ньютона. Реактивное движение Хроматография - физический метод разделения
Хроматография - физический метод разделения Презентация по физике Силы в природе
Презентация по физике Силы в природе  Агрегатные состояния вещества. 7 класс
Агрегатные состояния вещества. 7 класс Реальная жидкость. Вязкость
Реальная жидкость. Вязкость  Ультрафиолетового излучения
Ультрафиолетового излучения Презентация по физике "Видимое излучение" - скачать
Презентация по физике "Видимое излучение" - скачать  Основные понятия и определения современных систем управления движением судов
Основные понятия и определения современных систем управления движением судов