Содержание
- 2. Химия Строение атома Химическая связь Строение твердого тела Химическая термодинамика Химическая кинетика Равновесие в химических системах
- 3. I. Строение атома 3 этапа развития учения о строении атома 1 – Натурфилософские представления об атомном
- 4. Строение атома. Физические модели строения атома Эрнест Резерфорд - Планетарная модель атома (1911 г.) Эрвин Шредингер
- 5. Корпускулярно-волновой дуализм свойств материи [проблема природы лучистой энергии - эл.магн.излучения(ЭМИ)] Электромагнитное излучение Волна: λ - длина
- 6. (дуализм-общее свойство материи, а не только ЭМИ) - гипотеза-постулат о связи импульса P любого движущегося матер.объекта
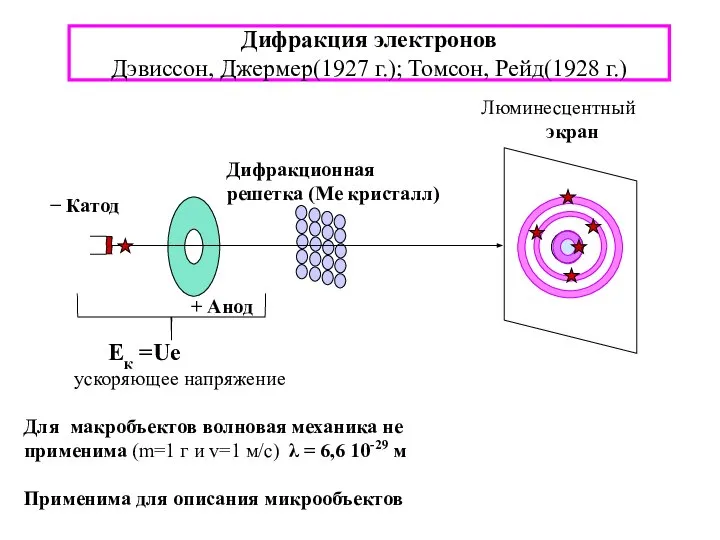
- 7. Дифракция электронов Дэвиссон, Джермер(1927 г.); Томсон, Рейд(1928 г.)
- 8. Принцип неопределенности [для микрочастиц(электрона)] Вернер Гейзенберг постулировал этот принцип в 1927 г. 0 ≤ Р ≤
- 9. График и уравнение волновой функции - плоской стоячей волны ψ(x,t) – для описания движения электрона
- 10. Уравнение Шредингера 1. Уравнение отображает волновой характер движения электрона в пространстве с координатами (x,y,z) Ψ(x,y,z,t) -
- 11. λ → m, Ek E = Ek + V E - полная энергия V- потенциальная энергия
- 12. Физический смысл волновой функции Ψ(x,y,z) - пси функция - волновая функция Макс Борн, 1926 г. волновая
- 13. Электрон в одномерном потенциальном ящике(яме). Решение ур. Шредингера. Потенциальная яма (ящик) - область пространства, вне которой
- 14. Нахождение волновой функции состояния электрона в потенц.ящике Решение в явном виде - набор волн.функций Ψ(х), где
- 15. Нахождение энергии электрона Набору ᴪ(x) соответствует набор Е, n = 1,2,3…- квантовое число
- 16. Электрон в связанном состоянии (потенциальном ящике) Выводы: Полная энергия – квантована(дискретна) дискретные значения Е: E1, E2,
- 17. Электрон в трехмерном потенциальном ящике Решение: a,b,c – параметры ящика nx, ny, nz – квантовые числа
- 18. Вырожденные энергетические состояния одно значение энергии – несколько наборов квантовых чисел - несколько волновых функций а
- 19. Квантово-механическая модель атома. Основное состояние атома водорода [k=1/4πε0] - константа в з-не Кулона x = r⋅sinϑ⋅cosϕ
- 20. Решение уравнения Шредингера для основного состояния атома водорода
- 21. Решение системы
- 22. Радиальное распределение электронной плотности. Понятие электронной орбитали 1.41 Å dV = 4πr2dr Объём сферич.слоя тощиной dr
- 23. Атом водорода в основном состоянии
- 24. Возбужденные состояния атома водорода Общий вид волновой функции - Ψ(r,θ,ϕ). Используя метод разделения переменных Ψ(r,θ,ϕ) представляют
- 25. Квантовые числа главное : n = 1,2,3,4…∞ Определяет разрешенные (квантованные, дискретные) значения полной энергии электрона, размер
- 26. n l = 0,1…(n-1) m = -l,…0,…+l Число орбиталей Энергия Еn 1 E2 2 1 0
- 27. Энергетическая диаграмма орбиталей в атоме водорода n=1 E1s
- 28. Функции радиального распределения электронной плотности для различных энергетических состояний атома водорода. Проникающая способность орбиталей: ns>np>nd Число
- 29. 1.7 Многоэлектронный атом (одноэлектронное приближение - водородоподобная система) Zэ = Z - σn,l Z – заряд
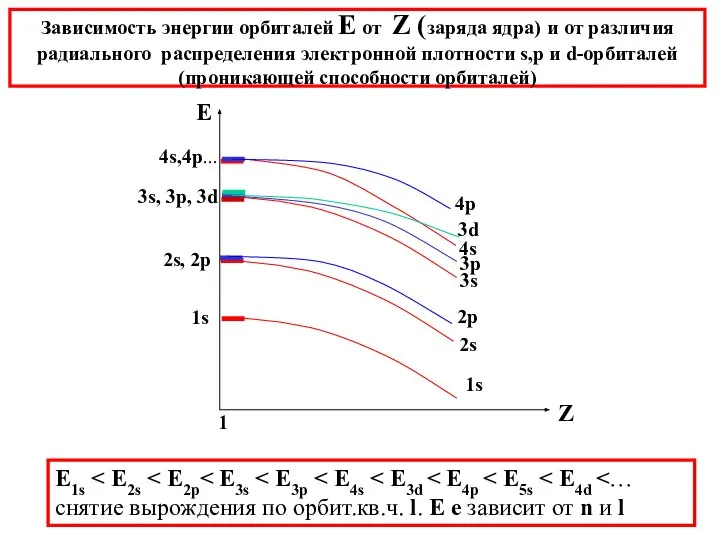
- 30. Зависимость энергии орбиталей Е от Z (заряда ядра) и от различия радиального распределения электронной плотности s,p
- 31. Таблица электронных орбиталей многоэлектронных атомов
- 32. Электронные конфигурации многоэлектронных атомов. Правила заселения электронами орбиталей 1. Принцип минимума энергии электронов. 2. Принцип (запрет)
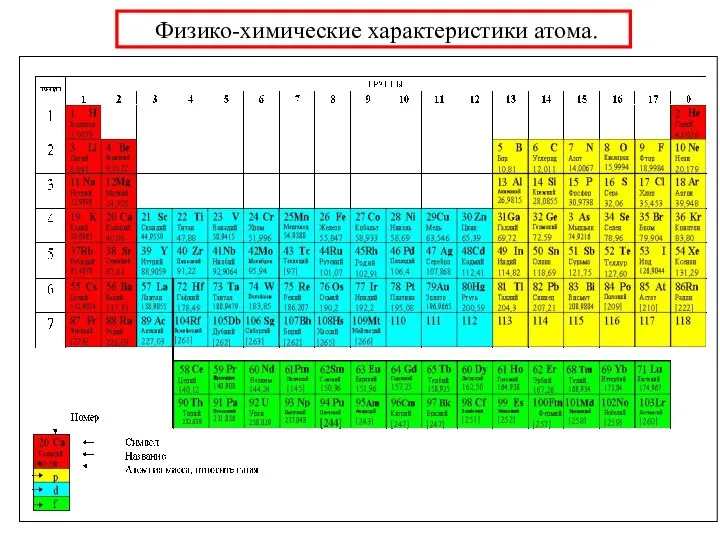
- 33. 1.8 Периодическая таблица элементов (1869)
- 34. Физико-химические характеристики атома. Радиус атома и иона
- 35. Ковалентный радиус ( RA = rсв /2) и радиус иона
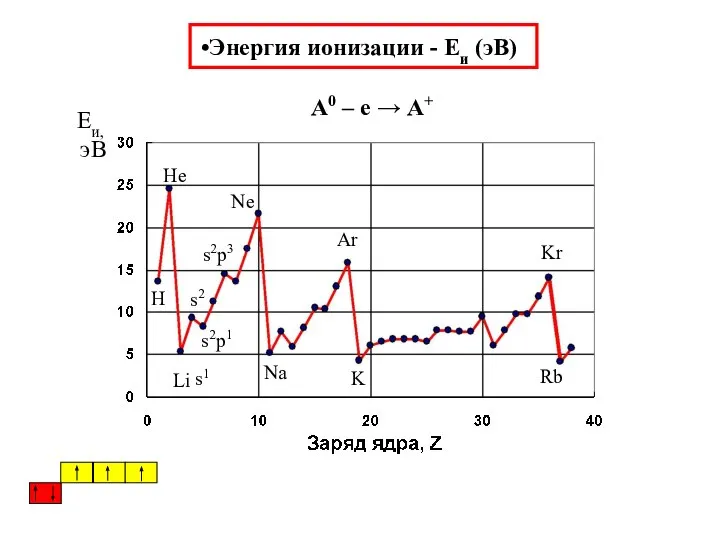
- 36. Энергия ионизации - Eи (эВ) А0 – е → А+ s1 s2 s2p1 s2p3
- 37. Энергия сродства к электрону – Е СЭ (эВ) A0 + e → A–
- 39. Скачать презентацию



![Корпускулярно-волновой дуализм свойств материи [проблема природы лучистой энергии - эл.магн.излучения(ЭМИ)] Электромагнитное](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1478060/slide-4.jpg)

![Принцип неопределенности [для микрочастиц(электрона)] Вернер Гейзенберг постулировал этот принцип в 1927](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1478060/slide-7.jpg)










![Квантово-механическая модель атома. Основное состояние атома водорода [k=1/4πε0] - константа в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1478060/slide-18.jpg)















 Свободное падение
Свободное падение Механическое движение
Механическое движение Задачи к закону Ома для полной цепи
Задачи к закону Ома для полной цепи «Теоретики - они рулевые» или научный путь профессора А. А. Кислицына
«Теоретики - они рулевые» или научный путь профессора А. А. Кислицына Виды теплообмена. В технике: водяное охлаждение двигателей, отопительный системы. Модель термоса
Виды теплообмена. В технике: водяное охлаждение двигателей, отопительный системы. Модель термоса Двигуни внутрішнього згоряння
Двигуни внутрішнього згоряння Презентация Работа газа и пара при расширении
Презентация Работа газа и пара при расширении  Фотоэлектрическая автономная система освещения
Фотоэлектрическая автономная система освещения Работа сил тяжести и упругости. Потенциальная энергия
Работа сил тяжести и упругости. Потенциальная энергия Презентация по физике "Шаровая молния" - скачать бесплатно
Презентация по физике "Шаровая молния" - скачать бесплатно Лазер - усиление света посредством вынужденного излучения
Лазер - усиление света посредством вынужденного излучения Теплотехника. Энтропия и первое начало термодинамики. (Лекция 4)
Теплотехника. Энтропия и первое начало термодинамики. (Лекция 4) Презентация Физические величины и их измерение
Презентация Физические величины и их измерение Примеры решения задач по теме Движение с постоянным ускорением свободного падения
Примеры решения задач по теме Движение с постоянным ускорением свободного падения Рентгеновское излучение и его применение
Рентгеновское излучение и его применение Уравнения состояния термодинамических систем. Лекция № 12
Уравнения состояния термодинамических систем. Лекция № 12 Презентация по физике АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
Презентация по физике АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА  Биоакустика Проект выполнили ученики 11 «А» класса Кушнарёв Данил Михайлович Руководитель: учитель физики Кубышева Наталья Вла
Биоакустика Проект выполнили ученики 11 «А» класса Кушнарёв Данил Михайлович Руководитель: учитель физики Кубышева Наталья Вла Анализ вращательной зависимости проявлений эффекта Дике
Анализ вращательной зависимости проявлений эффекта Дике ДЕЛЕНИЕ ЯДЕР УРАНА Ядерная физика
ДЕЛЕНИЕ ЯДЕР УРАНА Ядерная физика Лазер – важное открытие XX века. 11 класс
Лазер – важное открытие XX века. 11 класс Презентация по физике Компьютерное моделирование
Презентация по физике Компьютерное моделирование  Жоғарғы жиілікті разрядты зерттеудің маңыздылығы. Айнымалы электр өрісіндегі разрядтардың түрлері
Жоғарғы жиілікті разрядты зерттеудің маңыздылығы. Айнымалы электр өрісіндегі разрядтардың түрлері Технические и технологические характеристики подводного нефтепровода. Практическое занятие 1
Технические и технологические характеристики подводного нефтепровода. Практическое занятие 1 Аттестация 1. Электродинамика
Аттестация 1. Электродинамика Космология начала 20 века
Космология начала 20 века Радиосвязь и телевидение
Радиосвязь и телевидение Электрический ток в полупроводниках
Электрический ток в полупроводниках