Содержание
- 2. HHal – физические свойства
- 3. Способы получения галогеноводородов действием нелетучих кислот на хлориды металлов: H2SO4(конц.) + NaCl(тверд.) → NaHSO4 + HCl↑
- 4. Химические свойства галогеноводородов 1. В водном растворе галогеноводороды проявляют кислотные свойства: 2HCl + CaO → CaCl2
- 5. Химические свойства галогеноводородов 4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr –
- 6. Галогениды металлов - Способы получения 1. взаимодействие галогенов с металлами: Cl2 + Mg → MgCl2 Cl2
- 7. Химические свойства галогенидов 1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями,
- 8. Химические свойства галогенидов 2. Галогениды тяжелых металлов реагируют с более активными металлами: Mg + CuCl2 →
- 10. Скачать презентацию
Слайд 2
HHal – физические свойства
HHal – физические свойства
Слайд 3
Способы получения галогеноводородов
действием нелетучих кислот на хлориды металлов:
H2SO4(конц.) + NaCl(тверд.) →
Способы получения галогеноводородов
действием нелетучих кислот на хлориды металлов:
H2SO4(конц.) + NaCl(тверд.) →
NaHSO4 + HCl↑
прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
Слайд 4
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства:
2HCl + CaO →
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства:
2HCl + CaO →
CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют:
HF ↔ H+ + F–
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями :
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют:
HF ↔ H+ + F–
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями :
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
Слайд 5
Химические свойства галогеноводородов
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI:
Br2
Химические свойства галогеноводородов
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI:
Br2
+ 2HI → I2 + 2HBr
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
2HBr + H2O2 → Br2 + 2H2O
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
2HI + NO2 → I2 + NO + H2O
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
2HBr + H2O2 → Br2 + 2H2O
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
2HI + NO2 → I2 + NO + H2O
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
Слайд 6
Галогениды металлов - Способы получения
1. взаимодействие галогенов с металлами:
Cl2 + Mg → MgCl2
Cl2
Галогениды металлов - Способы получения
1. взаимодействие галогенов с металлами:
Cl2 + Mg → MgCl2
Cl2
+ Ca → CaCl2
3Cl2 + 2Fe → 2FeCl3
2. взаимодействие металлов с галогеноводородами:
Fe + 2HCl → FeCl2 + H2
3. взаимодействие основных и амфотерных оксидов с галогеноводородами:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. взаимодействие оснований и амфотерных гидроксидов с галогеноводородами:
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. взаимодействие солей с галогеноводородами:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
3Cl2 + 2Fe → 2FeCl3
2. взаимодействие металлов с галогеноводородами:
Fe + 2HCl → FeCl2 + H2
3. взаимодействие основных и амфотерных оксидов с галогеноводородами:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. взаимодействие оснований и амфотерных гидроксидов с галогеноводородами:
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. взаимодействие солей с галогеноводородами:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Слайд 7
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами
и основаниями, если образуется осадок, газ или вода.
NaCl + AgNO3 → AgCl↓ + NaNO3
Белый
NaBr + AgNO3 → AgBr↓ + NaNO3
Бледно-желтый
NaI + AgNO3 → AgI↓ + NaNO3
Жёлтый
Качественная реакция на галогенид-ионы!
NaCl + AgNO3 → AgCl↓ + NaNO3
Белый
NaBr + AgNO3 → AgBr↓ + NaNO3
Бледно-желтый
NaI + AgNO3 → AgI↓ + NaNO3
Жёлтый
Качественная реакция на галогенид-ионы!
Слайд 8
Химические свойства галогенидов
2. Галогениды тяжелых металлов реагируют с более активными металлами:
Mg + CuCl2
Химические свойства галогенидов
2. Галогениды тяжелых металлов реагируют с более активными металлами:
Mg + CuCl2
→ MgCl2 + Cu
3. Галогениды подвергаются электролизу в растворе или расплаве:
2KBr → 2K + Br2
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл:
2AgCl → 2Ag + Cl2
4. Галогениды металлов проявляют восстановительные свойства;
2KBr + 2H2SO4(конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4(конц.) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
3. Галогениды подвергаются электролизу в растворе или расплаве:
2KBr → 2K + Br2
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл:
2AgCl → 2Ag + Cl2
4. Галогениды металлов проявляют восстановительные свойства;
2KBr + 2H2SO4(конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4(конц.) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
- Предыдущая
Present perfect or Past simpleСледующая -
Налоговый механизм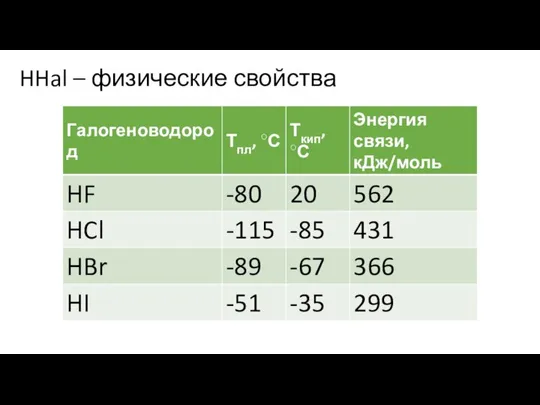






 От монументов до безделушек
От монументов до безделушек Ионообменная хроматография и ее применение
Ионообменная хроматография и ее применение Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Аргентум (Срібло)
Аргентум (Срібло) Технология производства хлорбензола
Технология производства хлорбензола «Голубое золото» 10 класс базовый уровень
«Голубое золото» 10 класс базовый уровень  Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф
Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф  История одного открытия
История одного открытия Предельные углеводороды
Предельные углеводороды Температура и тепловое равновесие
Температура и тепловое равновесие Презентация по Химии "Гетероциклические соединения" - скачать смотреть
Презентация по Химии "Гетероциклические соединения" - скачать смотреть  Избранные главы органической стереохимии
Избранные главы органической стереохимии Синтез органического соединения
Синтез органического соединения Синтетические моющие средства
Синтетические моющие средства Химические свойства насыщенных углеводородов
Химические свойства насыщенных углеводородов Общая геохимия
Общая геохимия Природные источники углеводородов и топливные ресурсы Западной Сибири
Природные источники углеводородов и топливные ресурсы Западной Сибири Презентация по Химии "Етери та естери" - скачать смотреть бесплатно
Презентация по Химии "Етери та естери" - скачать смотреть бесплатно Современные проблемы химической технологии вяжущих материалов
Современные проблемы химической технологии вяжущих материалов Классы неорганических веществ
Классы неорганических веществ Изделия на основе углеволокон
Изделия на основе углеволокон Алкадиены
Алкадиены ПРИРОДОВЕДЕНИЕ 5 КЛАСС
ПРИРОДОВЕДЕНИЕ 5 КЛАСС Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов
Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов Піридин. Способи добування та застосування
Піридин. Способи добування та застосування  Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз 2
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз 2 Глюкозаальдегидоспирт
Глюкозаальдегидоспирт