Сильные электролиты
Слабые электролиты
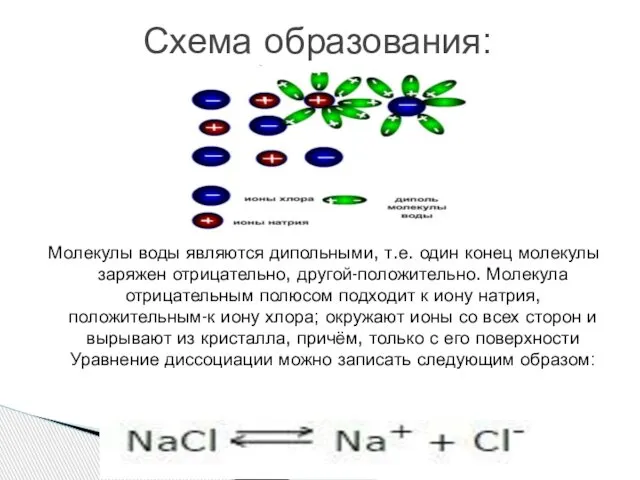
Сильные электролиты — химические соединения, молекулы которых в разбавленных
растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.












 Факторы влияющие на скорость химической реакции
Факторы влияющие на скорость химической реакции Презентация по Химии "Предмет химии. Вещества" - скачать смотреть
Презентация по Химии "Предмет химии. Вещества" - скачать смотреть  Комплексті қосылыстар
Комплексті қосылыстар Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Классификация лекарственных растений (ЛР) и лекарственного растительного сырья (ЛРС)
Классификация лекарственных растений (ЛР) и лекарственного растительного сырья (ЛРС) Строение атома. Периодичность свойств элементов и их соединений
Строение атома. Периодичность свойств элементов и их соединений Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Упражнения по теме «скорость химической реакции»
Упражнения по теме «скорость химической реакции» Предельные одноатомные спирты. 10 класс
Предельные одноатомные спирты. 10 класс Производные салициловой и индолуксусной кислоты
Производные салициловой и индолуксусной кислоты Презентация по химии Галогены в организме человека
Презентация по химии Галогены в организме человека Железо и его соединения
Железо и его соединения Физические явления в химии
Физические явления в химии Синтез нанопроволок, наностержней и нанотрубок неорганических соединений. (Лекция 8)
Синтез нанопроволок, наностержней и нанотрубок неорганических соединений. (Лекция 8) Химический элемент кремний
Химический элемент кремний Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Влияние пищевых добавок на здоровье человека
Влияние пищевых добавок на здоровье человека Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары
Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Дмитрий Иванович Менделеев 1834 - 1907
Дмитрий Иванович Менделеев 1834 - 1907 Thermodynamics
Thermodynamics Методика прогнозування наслідків виливу (викиду) небезпечних хімічних речовин при аваріях на промислових об`єктах і транспорті
Методика прогнозування наслідків виливу (викиду) небезпечних хімічних речовин при аваріях на промислових об`єктах і транспорті Цитология
Цитология Классификация веществ, вызывающих отравление. (Тема 4)
Классификация веществ, вызывающих отравление. (Тема 4) Ароматические углеводороды
Ароматические углеводороды