Содержание
- 2. Общая характеристика, методологические аспекты дробного метода анализа «металлических» ядов. В химико-токсикологическом анализе «металлических» ядов совокупность методов
- 3. На современном этапе (с точки зрения методологии) при ненаправленном химико-токсикологическом анализе группы токсикантов широко используются скрининговые
- 4. История развития системных методов анализа «металлических» ядов. Сравнительно долгое время в аналитической практике соединений металлов использовался
- 5. Аналитические группы (сероводородный метод анализа по Фрезениусу (1842 г)). 1 гр. K , Na , NH4
- 6. б) Второй этап сероводородного метода включал дальнейшее разделение и идентификацию отдельных катионов внутри аналитических групп, с
- 7. Сероводородный метод анализа соединений металлов длительное время использовался как в аналитической практике, так и в химико-токсикологическом
- 8. В связи с перечисленными недостатками, в настоящее время в судебно-химической (химико-токсикологической) практике, данный метод не используется,
- 9. Дробный метод анализа «металлических» ядов (определение, характеристика). Прежде всего следует отметить, что основы дробного метода анализа
- 10. Общее определение дробного метода анализа «металлических» ядов. Дробный метод анализа предусматривает обнаружение искомого металла в присутствии
- 11. Основные достоинства метода. 1. Максимальное применение специфических дробных реакций. 2. Большая чувствительность реакций в сочетании с
- 12. 4. Простота и доступность дробного метода для химико-токсикологических лабораторий (в т.ч. не используется газообразный сероводород). 5.
- 13. Методологические аспекты дробного метода анализа. Основные условия и приёмы, использованные А.Н. Крыловой при дробном исследовании «металлических»
- 14. Б. Основные приёмы маскировки мешающих ионов: 1. Применение для маскировки мешающих (фоновых) металлов неорганических комплексообразователей: а)
- 15. б) фторидов: Fe + 6 NaF → Na3[FeF6] + 3 Na гексафторферриат натрия в) фосфатов: Fe2(SO4)3
- 16. 2. Применение для маскировки мешающих (фоновых) металлов органических комплексообразователей (виннокаменная, лимонная кислоты и др.). 3. В
- 17. 5. В целях маскировки посторонних ионов используют малые объемы минерализата (особенно при исследовании марганца, хрома, мышьяка,
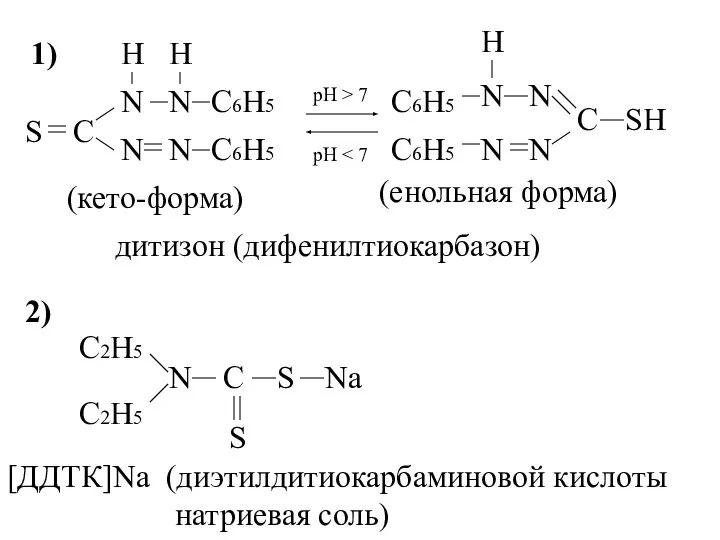
- 18. 1) S C N N N N H H C6H5 C6H5 рН > 7 рН C6H5
- 19. 7. Применение определённой последовательности анализа отдельных «металлических» ядов: а) Исследованию на ионы серебра предшествуют исследования на
- 20. Пример селективной экстракции на примере свинца. Сущность. Искомый металл изолируют от сопутствующих элементов, с использованием комплексообразователя
- 21. 2 этап – На втором этапе производится реэкстрагирование свинца в водную фазу в ионогенном состоянии (из
- 22. Приём селективной экстракции свинца из минерализата 1 этап – селективная экстракция в виде дитизоната свинца: (СH3COO)2Pb
- 23. 2 этап – реэкстрагирование свинца в водную фазу: N N C N NH ¨ Pb/ 2
- 24. 2. Исследование минерализата на наличие свинца и бария в осадке. Прежде чем приступить к рассмотрению схем
- 25. Men+ Общие этапы дробного анализа «металлических» ядов (по А.Н. Крыловой)
- 26. Схема исследования свинца и бария в минерализате дробным методом (по А.Н. Крыловой). осадок (PbSO4 ) осадок
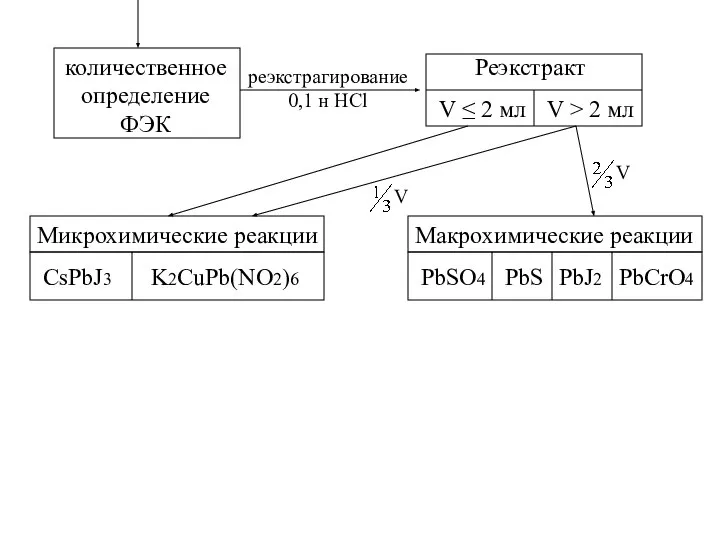
- 27. количественное определение ФЭК реэкстрагирование 0,1 н HCl Реэкстракт V ≤ 2 мл V > 2 мл
- 28. нас. CH3COONH4 осадок (BaSO4) Качественное обнаружение Количественное определение (весовой метод) реакции перекристаллизации Восстановление BaSO4 → BaS
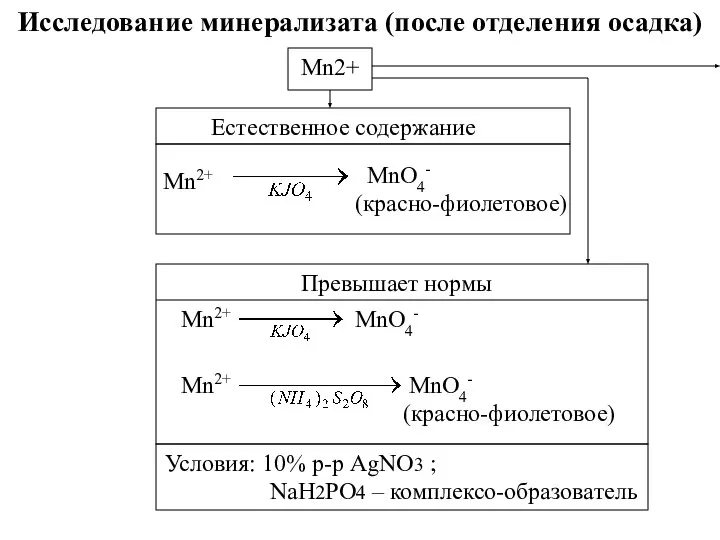
- 29. Исследование минерализата (после отделения осадка) Mn2+ Естественное содержание Mn2+ MnO4- (красно-фиолетовое) Превышает нормы Mn2+ MnO4- MnO4-
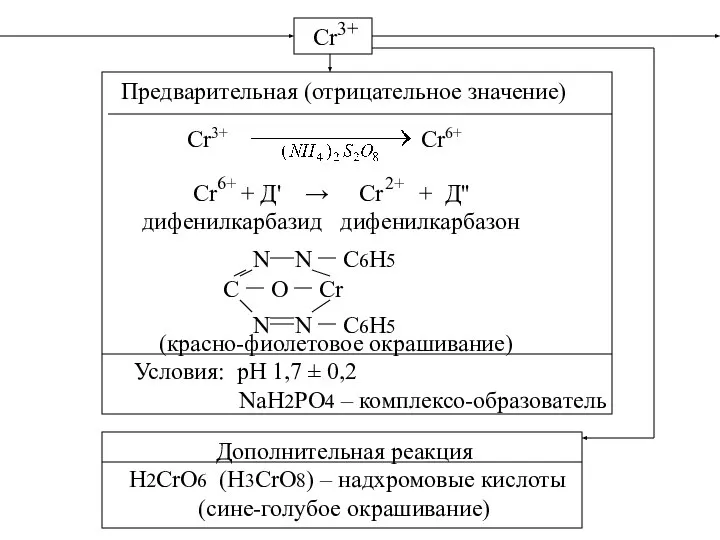
- 30. Cr 3+ Предварительная (отрицательное значение) Cr3+ Cr6+ Cr + Д' → Cr + Д'' дифенилкарбазид дифенилкарбазон
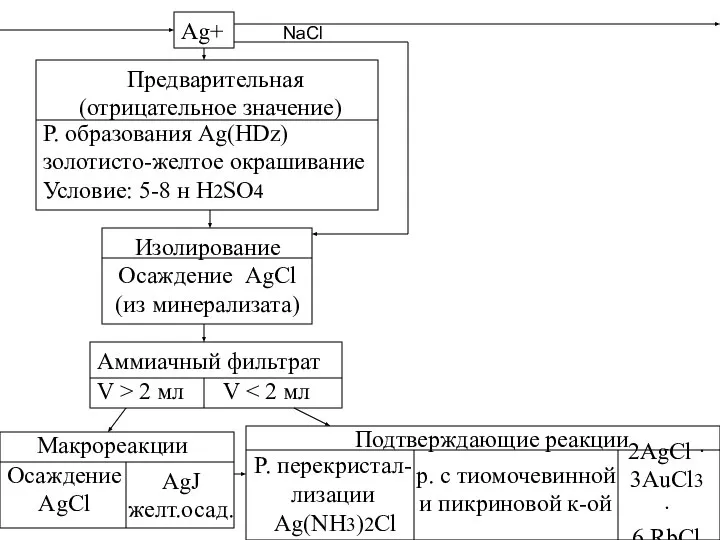
- 31. Ag+ Предварительная (отрицательное значение) Р. образования Ag(HDz) золотисто-желтое окрашивание Условие: 5-8 н H2SO4 Изолирование Осаждение AgCl
- 32. Cu 2+ экстракция хлороформ (ДДТК)2Pb (рН – 3,0) Изолирование, предварительное обнаружение (ДДТК)2Cu желто-коричневое окрашивание реэкстракция HgCl2
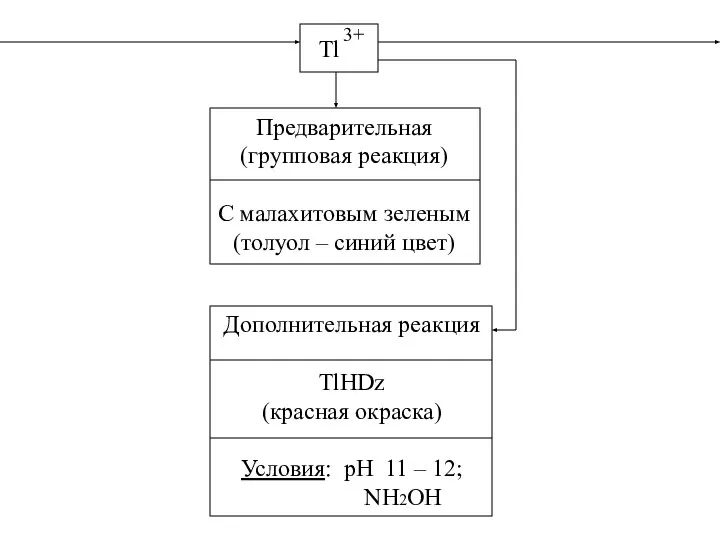
- 33. Tl 3+ Предварительная (групповая реакция) С малахитовым зеленым (толуол – синий цвет) Дополнительная реакция TlHDz (красная
- 34. Bi 3+ Предварительные реакции (отрицательное значение) Йодвисмутат оксина (желтое окрашивание) Условия: рН ≥ 6,5; аскорбиновая кислота
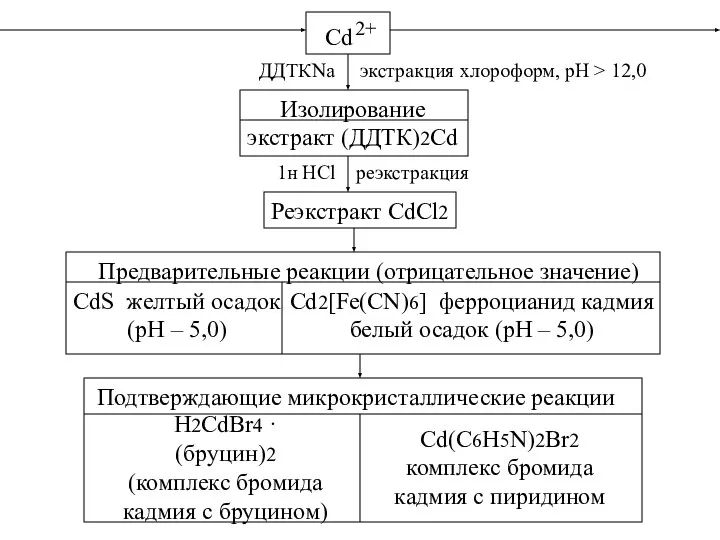
- 35. Cd 2+ ДДТКNa экстракция хлороформ, рН > 12,0 Изолирование экстракт (ДДТК)2Cd 1н HCl реэкстракция Реэкстракт CdCl2
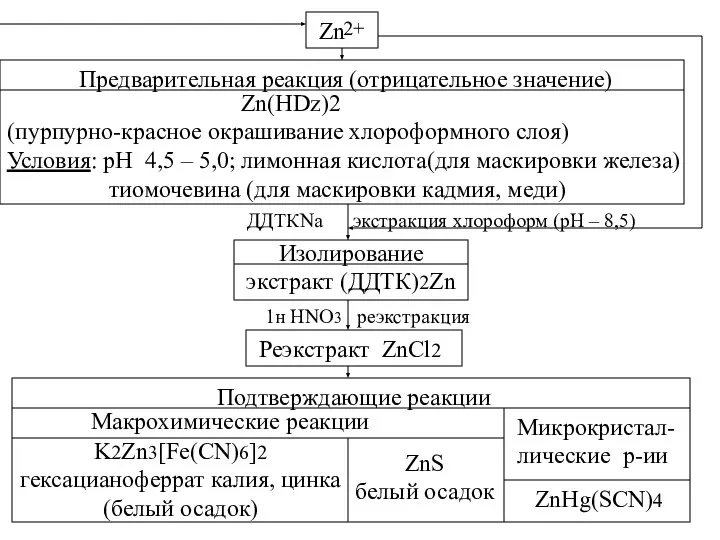
- 36. Zn 2+ Предварительная реакция (отрицательное значение) Zn(HDz)2 (пурпурно-красное окрашивание хлороформного слоя) Условия: рН 4,5 – 5,0;
- 38. Скачать презентацию













![б) фторидов: Fe + 6 NaF → Na3[FeF6] + 3 Na](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/632886/slide-14.jpg)













 Топливо и его свойства
Топливо и его свойства Квалификация химических реактивов, принятая в РФ
Квалификация химических реактивов, принятая в РФ Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Комплексные соединения. Лекция № 3
Комплексные соединения. Лекция № 3 Ферменти мікробіологічного синтезу
Ферменти мікробіологічного синтезу Анілін. Фізичні властивості
Анілін. Фізичні властивості Биохимия нервной и мышечной ткани
Биохимия нервной и мышечной ткани Реакции горения и материальный баланс котла
Реакции горения и материальный баланс котла Устойчивость и коагуляция коллоидных растворов
Устойчивость и коагуляция коллоидных растворов Молекулярная адсорбция. (Лекция 2)
Молекулярная адсорбция. (Лекция 2) Железо Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности,
Железо Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности,  Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика
Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика ГИА. А1: Строение атомов первых 20 химических элементов ПСХЭ
ГИА. А1: Строение атомов первых 20 химических элементов ПСХЭ Стартап. Производство минерального удобрения
Стартап. Производство минерального удобрения Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Правила техники безопасности. Приемы обращения с лабораторным оборудованием
Правила техники безопасности. Приемы обращения с лабораторным оборудованием Карбонові кислоти. Насичені карбонові кислоти
Карбонові кислоти. Насичені карбонові кислоти Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Количество вещества
Количество вещества Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Химиялық реакцияның жылдамдығы. Катализ
Химиялық реакцияның жылдамдығы. Катализ Автоматизована мікропроцесорна система контролю концентрації речовин в розчинах
Автоматизована мікропроцесорна система контролю концентрації речовин в розчинах “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Качество питьевой воды
Качество питьевой воды Основные законы химии
Основные законы химии Рецепторы анионов
Рецепторы анионов Мұнай, құрамыөңдеу әдістері
Мұнай, құрамыөңдеу әдістері Фосфор, строение, свойства
Фосфор, строение, свойства