Содержание
- 2. Жоспар: Химиялық байланыстардың түрлері Иондық байланыс Ковалентті байланыс Сутектік байланыс Металдық байланыс
- 3. Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы өзгеріске ұшырайды. Атомдардың электрондық құрылымы анағұрлым тұрақты болған жағдайда
- 4. Сыртқы электрондық қабаты ns2np6 типті болған жағдайда электронды октет және 1 s2 аяқталған, анағұрлым тұрақты болады.
- 5. Иондық химиялық байланыс электртерістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Иондық химиялық байланыс
- 6. Иондық байланыс теориясын 1916 жылы неміс ғалымы В. Коссель ұсынған болатын. Бұл теория типтік металдар мен
- 8. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың
- 9. натрий атом
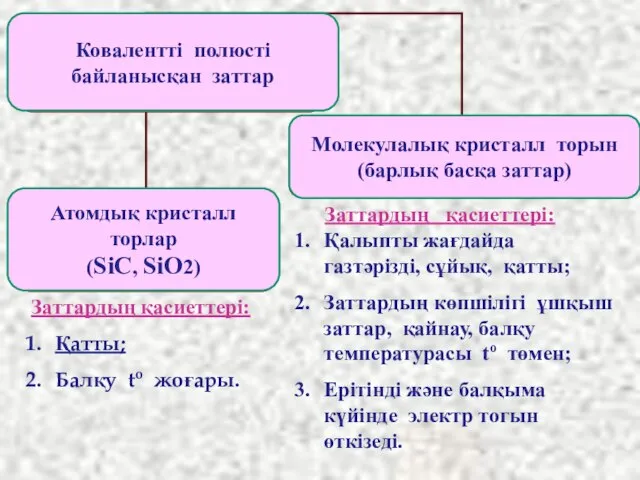
- 11. Ковалентті байланыс – бұл атомдар арасында ортақ электрондық жұп есебінен жүзеге асырылатын химиялық байланыс. Ковалентті байланыс
- 12. Джильбер Льюис
- 13. Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасады. Полюссіз химиялық байланыстағы
- 14. Сутек атомының электрондық формуласы 1s1. Сутектің электртерістілігі 2,1. S – электрондарының электрон бұлттары сфера (шар) тәрізді,
- 15. Сутегі молекуласындағы атомдардың ұсталып тұрған күштерінің табиғатын алғаш 1927 жылы ағылшын ғалымдары Гейтлер мен Лондон кванттық
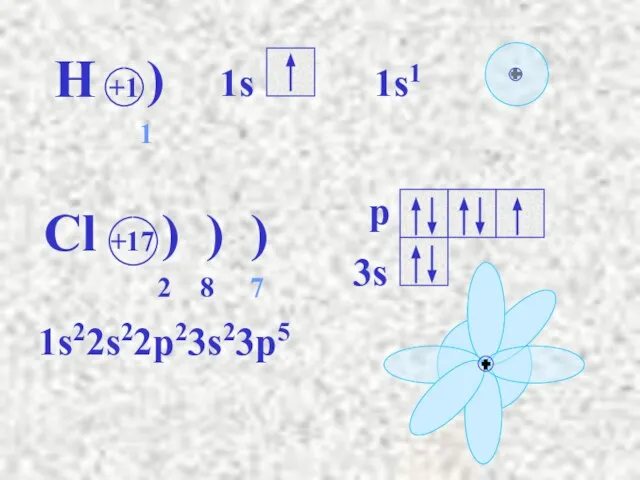
- 16. H +1 ) 1
- 17. H- -H H2 Сутек молекуласындағы байланыстың түзілуі:
- 19. Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент атомына қарай ығыса орналасқан байланыс.
- 20. Cl +17 ) ) ) 2 8 7 1s22s22p23s23p5 H +1 ) 1
- 22. Металдық байланыстың түзілу схемасы (М – металл): Me – ne- → Me+n Мұндай қабілетті металдар бос
- 23. Химиялық байланыстың негізгі сипаттамалары: байланыс энергиясы байланыс ұзындығы валенттік бұрыш Байланыс энергиясы – өзара байланысқан атомдарды
- 25. Скачать презентацию




















 Химическая связь
Химическая связь Главная подгруппа IV группы
Главная подгруппа IV группы Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Химическая термодинамика. (Лекция 4)
Химическая термодинамика. (Лекция 4) Методи визначення питомої поверхні
Методи визначення питомої поверхні Анализ ЕГЭ по химии 2011
Анализ ЕГЭ по химии 2011 XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды Фосфор и его соединения
Фосфор и его соединения Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся
Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся  Презентация Воздух, его состав и значение.
Презентация Воздух, его состав и значение.  Гетерофункціональні сполуки. Галогенозамiщенi кислоти
Гетерофункціональні сполуки. Галогенозамiщенi кислоти Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3
Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3 Средние породы
Средние породы Chemistry quiz
Chemistry quiz Физико-химические основы дезодорации растительных масел
Физико-химические основы дезодорации растительных масел Тотығып фосфорлану
Тотығып фосфорлану Хлор
Хлор Презентация Фосфор 9 класс
Презентация Фосфор 9 класс Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Второй закон термодинамики
Второй закон термодинамики Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Термодинамика поверхностных явлений. (Часть 1)
Термодинамика поверхностных явлений. (Часть 1) Бериллий: основные свойства, технологии получения, применение
Бериллий: основные свойства, технологии получения, применение Химические свойства металлов
Химические свойства металлов Коррозия металлов
Коррозия металлов Химические реакции
Химические реакции