Содержание
- 2. Электролитическая теория первая научная ионная теория кислот и оснований (Оствальд, Аррениус, 1890 год). Согласно этой теории,
- 3. Амфотерность А. Ганч в 1917-1927 годах ввел понятие об амфотерности - способности некоторых соединений проявлять как
- 4. Теории кислот и оснований протолитическая (И. Бренстед и Т. Лоури) и электронная (Г. Льюис) теории кислот
- 5. В протолитической теории Вода принята за своеобразный стандарт для оценки кислотно-основных свойств веществ - стандарт нейтральной
- 6. Почему вода? Вода - одно из самых распространенных на Земле соединений. Ее кислотно-основные свойства определяют естественный
- 7. Количественная мера кислотности и основности Кислотность соединений количественно оценивается долей ионизированной формы вещества в растворе (воде)
- 8. Принцип ЖМКО Пирсона (1963) Кислоты и основания Льюиса делятся на жёсткие и мягкие, причём мягкие кислоты
- 9. Жесткие кислоты Жесткие основания -низкая поляризуемость -низкая поляризуемость -малый объем -малый объем -высокое сродство к электрону
- 10. Мягкие кислоты Мягкие основания -высокая поляризуемость -высокая поляризуемость -большой объем -большой объем -низкая НСМО -высокая ВЗМО
- 11. Классификация кислот и оснований в рамках принципа ЖМКО
- 12. Помимо условного деления на три типа, можно также проследить зависимость жёсткости или мягкости в рядах отдельных
- 13. Ж. кис.+ Ж. осн. = Зарядовый контроль Высоколежащая НСМО к-ты + низколежащая ВЗМО осн-я. Определяющая роль
- 14. Зарядовый контроль Орбитальный контроль ВЗМО НСМО НСМО ВЗМО ΔE = - qDqA rDε ΔE = 2ΣΣ(cBcAβ)2
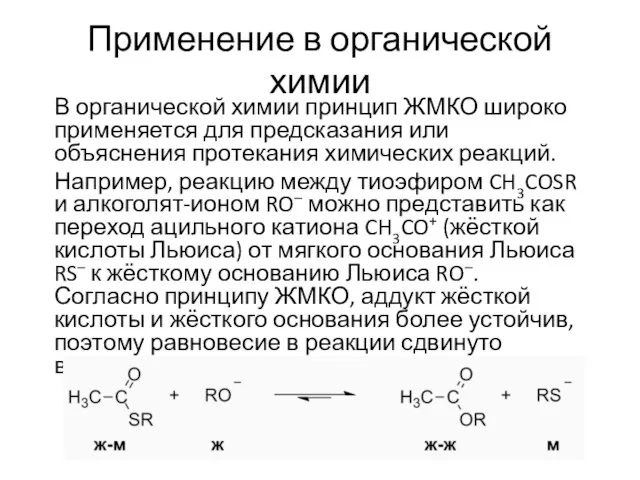
- 15. Применение в органической химии В органической химии принцип ЖМКО широко применяется для предсказания или объяснения протекания
- 16. Принцип Пирсона также полезен для предсказания реакционной способности соединений с двумя реакционными центрами, например, енолят-ионов или
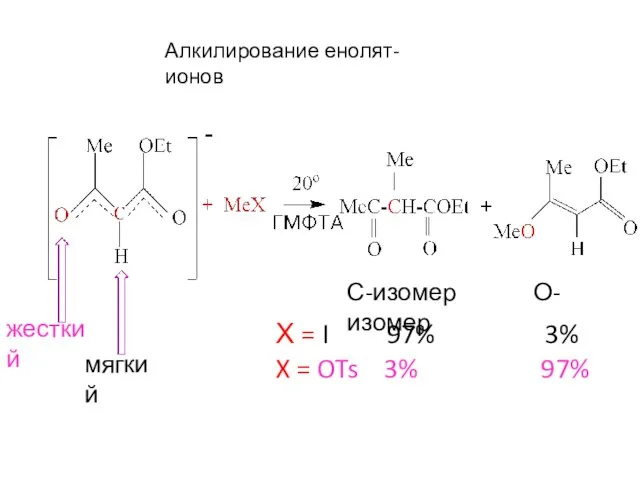
- 17. Алкилирование енолят-ионов С-изомер О-изомер Х = I 97% 3% X = OTs 3% 97% Жесткий основный
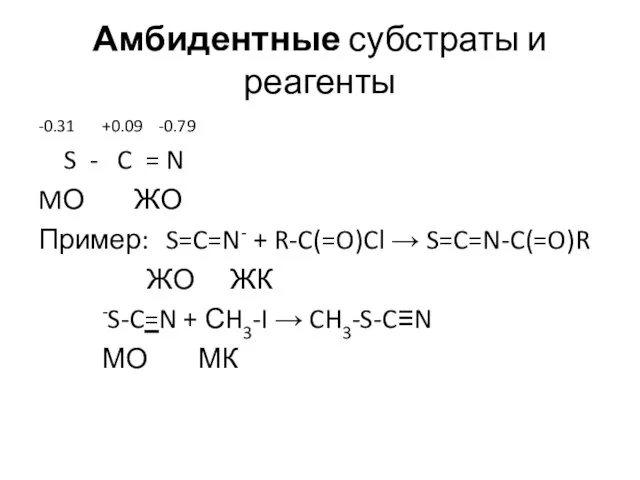
- 18. Амбидентные субстраты и реагенты -0.31 +0.09 -0.79 S - C = N MО ЖО Пример: S=C=N-
- 19. Амбидентность нитрит – иона O- – N = O ЖО МО С8H17Br + AgNO2 → C8H17O-N=O
- 20. Амбидентность енолят-аниона (С2H5)3OF (фторид триэтилоксония) – очень жесткий реагент – алкилирует енолят –анион по атому О
- 21. Алкилирование енолят-ионов С-изомер О-изомер Х = I 97% 3% X = OTs 3% 97% жесткий мягкий
- 23. Скачать презентацию

















 Витамины. Ашылу тарихы
Витамины. Ашылу тарихы ЖИДКИЕ КРИСТАЛЛЫ И ПРИБОРЫ НА ИХ ОСНОВЕ В настоящее время технологии жидкокристаллических мониторов ЖК были известны химик
ЖИДКИЕ КРИСТАЛЛЫ И ПРИБОРЫ НА ИХ ОСНОВЕ В настоящее время технологии жидкокристаллических мониторов ЖК были известны химик Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева Алкины. Химические и физические свойства алкинов
Алкины. Химические и физические свойства алкинов Aqueous Solutions of Electrolytes
Aqueous Solutions of Electrolytes Презентация по Химии "Атоми,молекули, йони, хімічні елементи, їхні назви й символи" - скачать смотреть бесплатно
Презентация по Химии "Атоми,молекули, йони, хімічні елементи, їхні назви й символи" - скачать смотреть бесплатно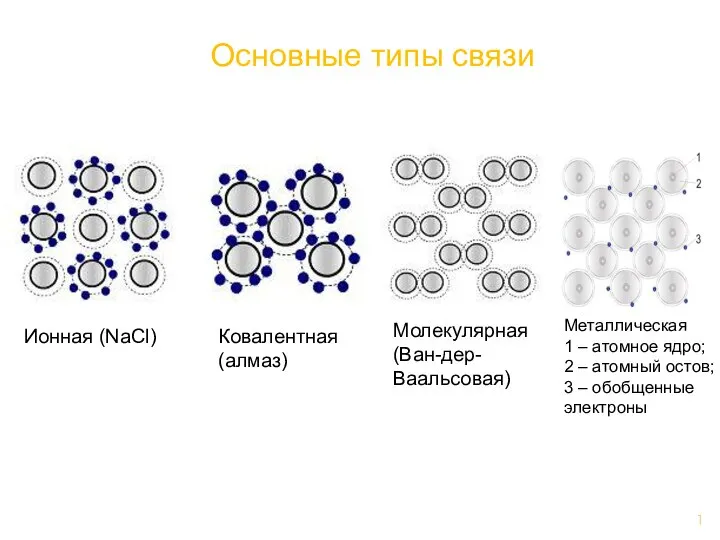 Основные типы связи
Основные типы связи Дослідження розчинності речовин природознавство
Дослідження розчинності речовин природознавство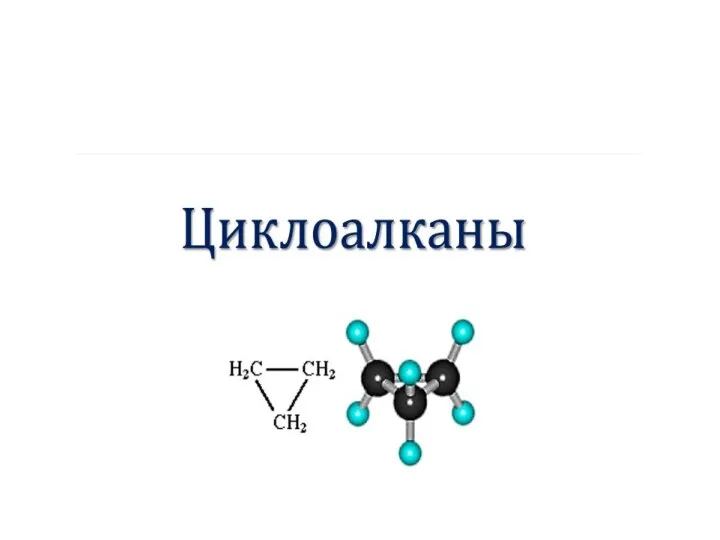 Циклоалканы. Номенклатура
Циклоалканы. Номенклатура Жири як компоненти їжі. Їхня роль в організмі
Жири як компоненти їжі. Їхня роль в організмі  Жыныс гормондарының түзілуі және маңызы
Жыныс гормондарының түзілуі және маңызы Сероводород
Сероводород Bool-doser team
Bool-doser team Самозаймання речовин та матеріалів. Особливості самозаймання. Види самозаймання
Самозаймання речовин та матеріалів. Особливості самозаймання. Види самозаймання Катодные процессы при коррозии металла
Катодные процессы при коррозии металла Скорость химической реакции
Скорость химической реакции Растворы и их классификация
Растворы и их классификация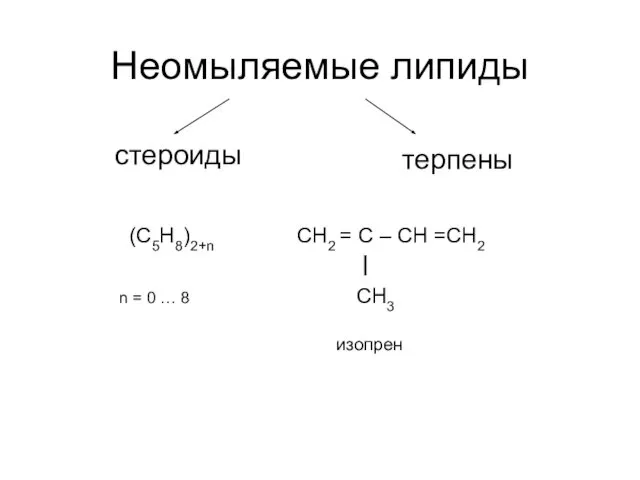 Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Ископаемое топливо
Ископаемое топливо Давайте повторим Заключительный урок в 8 классе
Давайте повторим Заключительный урок в 8 классе  Комбинированные задачи. Задание 34
Комбинированные задачи. Задание 34 Опасность озоновых дыр
Опасность озоновых дыр Соли
Соли Углеводы. Карбоновые кислоты и их производные
Углеводы. Карбоновые кислоты и их производные Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Молярный объём газообразного вещества
Молярный объём газообразного вещества Тепловой эффект химических реакций
Тепловой эффект химических реакций Структурно-механiчнi (реологiчнi) властивостi харчових мас
Структурно-механiчнi (реологiчнi) властивостi харчових мас