Содержание
- 2. Коллигативными называются свойства растворов, зависящие от типа растворителя и концентрации растворенного вещества, но не зависящие от
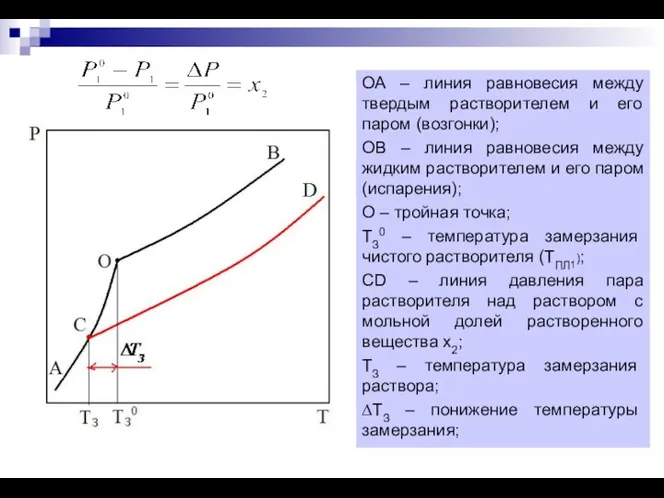
- 3. Понижение температура замерзания растворов. Криоскопия. Криоскопия – метод изучения свойств растворов, основанный на измерении температур замерзания
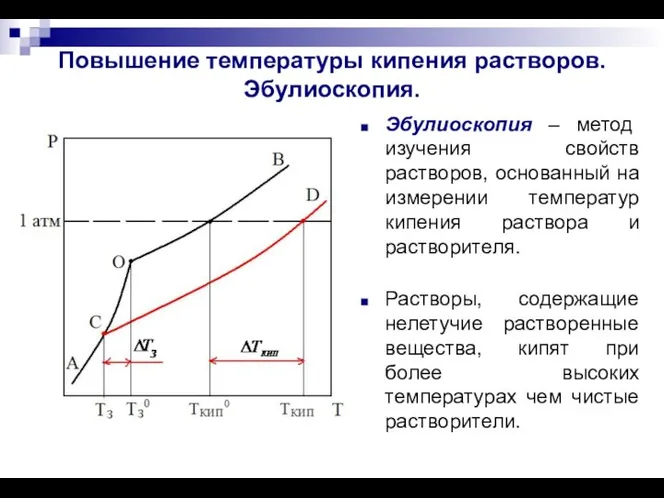
- 6. Повышение температуры кипения растворов. Эбулиоскопия. Эбулиоскопия – метод изучения свойств растворов, основанный на измерении температур кипения
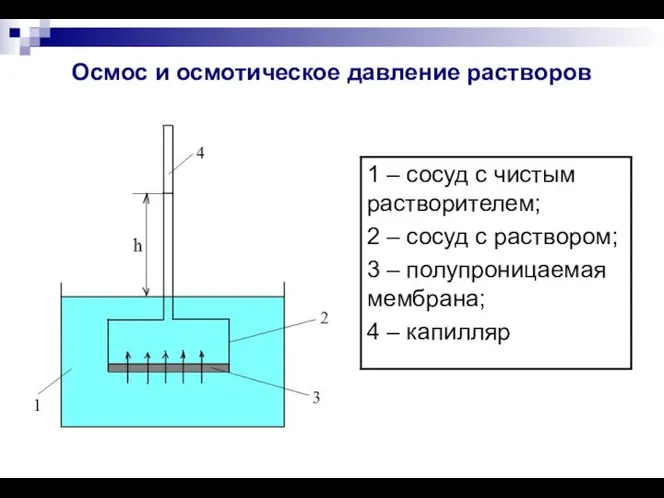
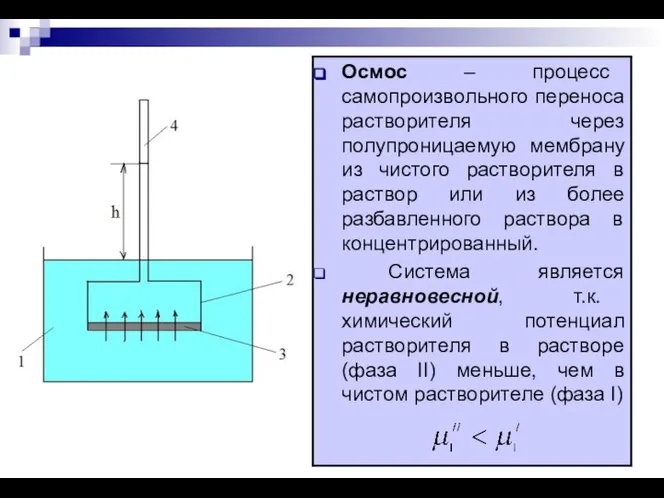
- 9. Осмос и осмотическое давление растворов
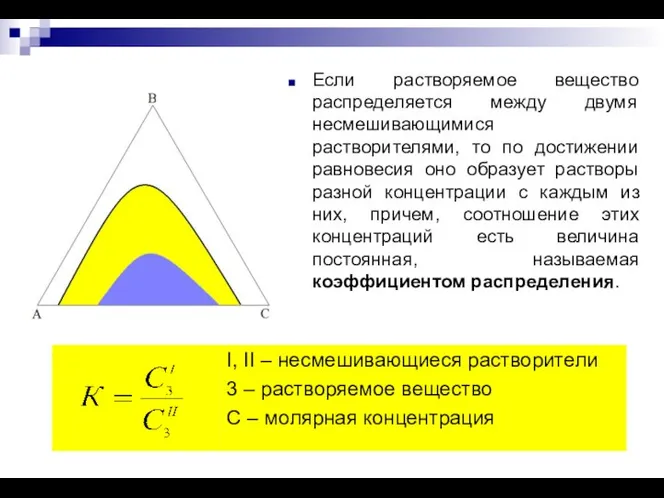
- 13. Растворение вещества в двух несмешивающихся растворителях. Закон распределения. Экстракция.
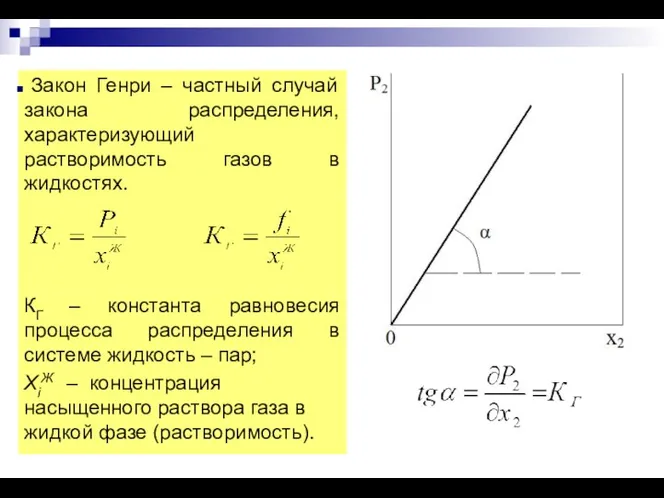
- 14. Если растворяемое вещество распределяется между двумя несмешивающимися растворителями, то по достижении равновесия оно образует растворы разной
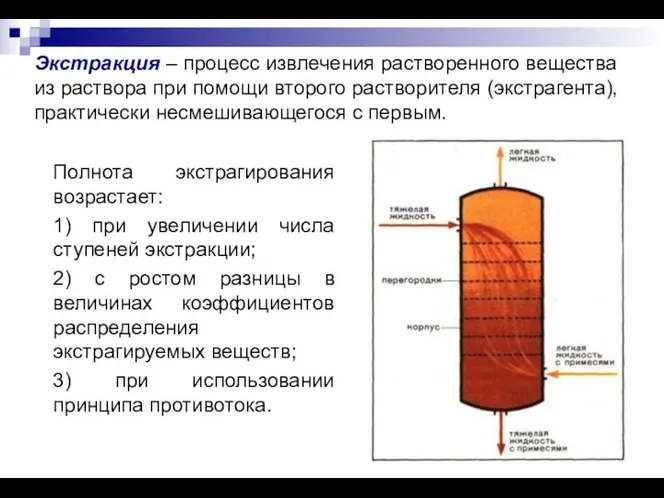
- 18. Экстракция – процесс извлечения растворенного вещества из раствора при помощи второго растворителя (экстрагента), практически несмешивающегося с
- 19. Экспериментальные методы определения активности и коэффициента активности
- 21. Скачать презентацию











 Типы ингибирования и их характерные черты
Типы ингибирования и их характерные черты Лекарственное растительное сырье, содержащее полисахариды
Лекарственное растительное сырье, содержащее полисахариды Підготувала учениця 11-А класу Білецька Олеся
Підготувала учениця 11-А класу Білецька Олеся  Крайнюк Мария 11-Б
Крайнюк Мария 11-Б  Типы химических реакций
Типы химических реакций Биологическая химия с основами физической и коллоидной химии
Биологическая химия с основами физической и коллоидной химии Діагностика за показами газоаналізатора. Типи газоаналізаторів
Діагностика за показами газоаналізатора. Типи газоаналізаторів ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ЛИТЕРАТУРА: Мухленов И.П. «Общая химическая технология» - М.: Высшая школа, 1984, ч.1-2, 264с. Гутник С.
ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ЛИТЕРАТУРА: Мухленов И.П. «Общая химическая технология» - М.: Высшая школа, 1984, ч.1-2, 264с. Гутник С. Электрохимия. Понятие о двойном электрическом слое (ДЭС)
Электрохимия. Понятие о двойном электрическом слое (ДЭС) Структурно-функциональные основы протеомики. Первичная структура белка
Структурно-функциональные основы протеомики. Первичная структура белка Щелочные металлы
Щелочные металлы История микроскопа
История микроскопа  Превращение веществ
Превращение веществ Маңызды химиялық өндірістер
Маңызды химиялық өндірістер Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Сера. Сероводородная, серная и сернистая кислоты.
Сера. Сероводородная, серная и сернистая кислоты.  Повышение эффективности процесса сополимеризации бутадиена и α-метилстирола. Производительность 83000 т/год
Повышение эффективности процесса сополимеризации бутадиена и α-метилстирола. Производительность 83000 т/год Электроизоляционные материалы. Лаки и класки
Электроизоляционные материалы. Лаки и класки Технології переробки твердих побутових відходів Виконала учениця групи П-13 Бермес Мар’яна
Технології переробки твердих побутових відходів Виконала учениця групи П-13 Бермес Мар’яна  Презентация по Химии "«Родословная Д. И. Менделеева»" - скачать смотреть
Презентация по Химии "«Родословная Д. И. Менделеева»" - скачать смотреть  Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине
Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине МБОУ СОШ №33 г. Электроугли Крахмал авторы исследовательского проекта Филимонова Мария Алексеева Кристина 10 класс руководи
МБОУ СОШ №33 г. Электроугли Крахмал авторы исследовательского проекта Филимонова Мария Алексеева Кристина 10 класс руководи Ocena zawartości mikotoksyn w wybranych produktach spożywczych
Ocena zawartości mikotoksyn w wybranych produktach spożywczych Великие ученые XIX-XX веков
Великие ученые XIX-XX веков Постер: применение трековых мембран для электрохимического осаждения наноструктур на основе Ni/CoIX
Постер: применение трековых мембран для электрохимического осаждения наноструктур на основе Ni/CoIX Стадии и общая схема почвообразования
Стадии и общая схема почвообразования Простые вещества
Простые вещества Комплекс заходів з ліквідації наслідків радіаційне небезпечної надзвичайної ситуації
Комплекс заходів з ліквідації наслідків радіаційне небезпечної надзвичайної ситуації