Содержание
- 2. Граф логической структуры темы
- 3. Двойной электрический слой Наличие у частиц дисперсных систем электрического заряда было открыто ещё в 1808 году
- 4. Двойной электрический слой Двойным электрическим слоем (ДЭС) – называется упорядоченное распределение противоположно заряженных частиц на межфазной
- 6. 2.Электростатическое взаимодействие между адсорбированными ионами и ионами противоположного знака- противоионами. Эти ионы близко подходят к поверхности
- 7. Двойной электрический слой 3.Диффузия. За счёт диффузии часть противоионов переходит из адсорбционного слоя в раствор вблизи
- 8. избыток
- 9. Строение коллоидных частиц При электрофорезе золь перемещается к аноду (+) Золи имеют мицеллярное строение
- 11. При электрофорезе золь перемещается к катоду (-)
- 12. избыток a d a-адсорбционный слой,d- диффузный слой r
- 13. 1. Электродинамический (электростатический) потенциал φ - потенциал, соответствующий заряду потенциалопределяющих ионов. (определяет знак заряда гранулы!!!!) 2.
- 14. Формула мицеллы золя золота 1) Реакции восстановления
- 15. 2. Реакции восстановления мицелла MnO2 (при электрофорезе движется к аноду)
- 16. 3.Реакции двойного обмена избыток избыток движется к аноду движется к катоду
- 17. Способы определения знака заряда коллоидных частиц 1. Электрофорез - перемещение заряженных частиц дисперсной фазы относительно дисперсионной
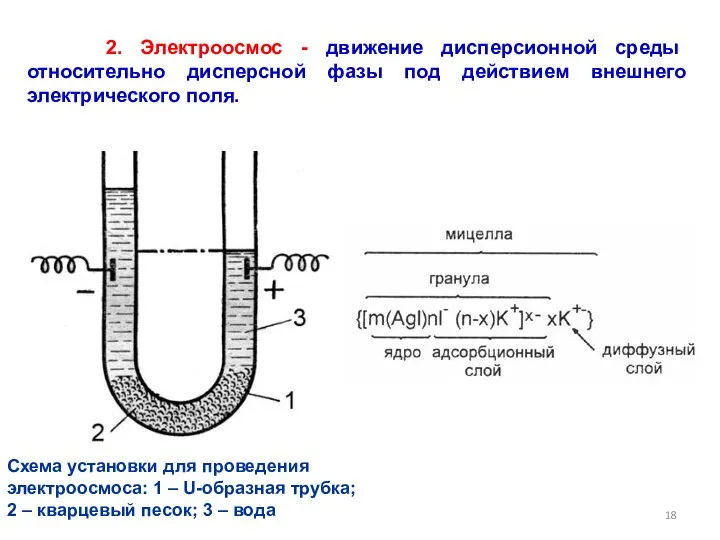
- 18. 2. Электроосмос - движение дисперсионной среды относительно дисперсной фазы под действием внешнего электрического поля. Схема установки
- 19. (Правило знака и валентности - Шульце-Гарди) Коагуляцию коллоидных растворов вызывают любые ионы, которые имеют знак заряда,
- 20. Состоит из спаянных медной и цинковой пластинок. При погружении в коллоидный раствор пластинка меди заряжается отрицательно,
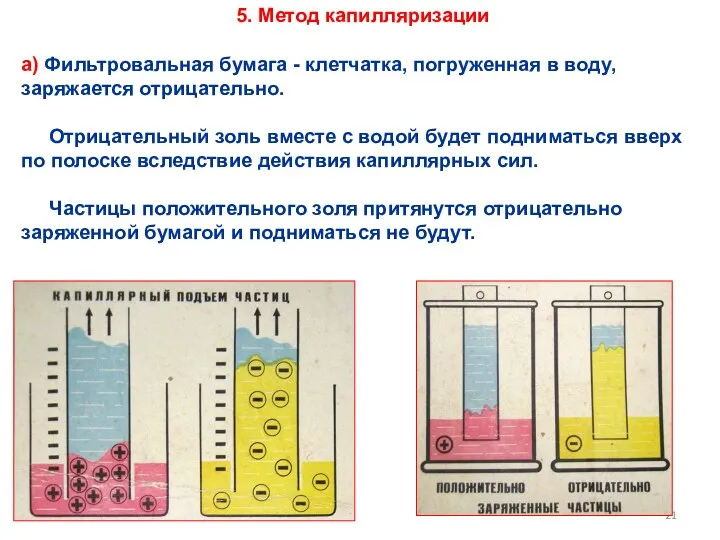
- 21. а) Фильтровальная бумага - клетчатка, погруженная в воду, заряжается отрицательно. Отрицательный золь вместе с водой будет
- 22. б) Каплю золя помещаем на бумажный фильтр. По фиксации или размыву окрашенного золя делаем вывод о
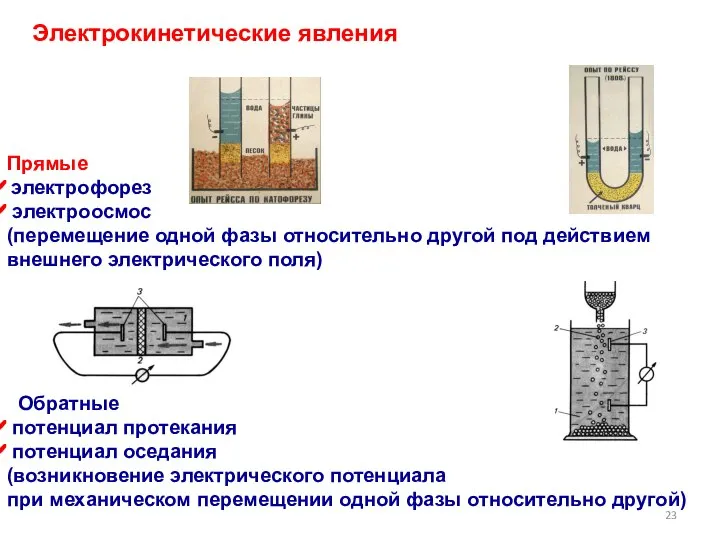
- 23. Электрокинетические явления Прямые электрофорез электроосмос (перемещение одной фазы относительно другой под действием внешнего электрического поля) Обратные
- 24. При действии электрического поля гранула движется к одному полюсу (электрофорез) ионы диффузного слоя, увлекая за собой
- 25. Электрофорез - движение заряженных частиц дисперсной фазы относительно неподвижной дисперсионой среды под действием внешнего электрического поля.
- 26. Скорость электрофореза определяется формулой:
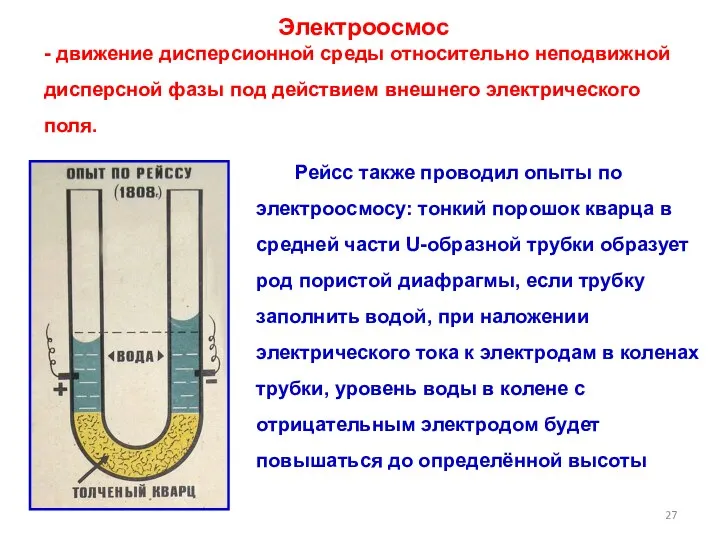
- 27. Электроосмос - движение дисперсионной среды относительно неподвижной дисперсной фазы под действием внешнего электрического поля. Рейсс также
- 28. Скорость электроосмоса определяется формулой: -удельная электропроводность
- 29. Потенциал протекания (эффект Квинке - 1859 г.) - разность потенциалов, возникающая при движении дисперсионной среды относительно
- 30. Е - потенциал протекания Р - давление -удельная электропроводность
- 31. Потенциал оседания (Эффект Дорна или потенциал седиментации - 1878г.) - разность потенциалов, возникающая при движении частиц
- 33. 1. Разделение и анализ смесей макромолекул (белков сыворотки крови, спинномозговой жидкости, мочи ) 2. Определение изоэлектрической
- 34. 5. Диагноз и контроль за ходом болезней а) при сердечно-сосудистых заболеваниях (зубец q – связан c
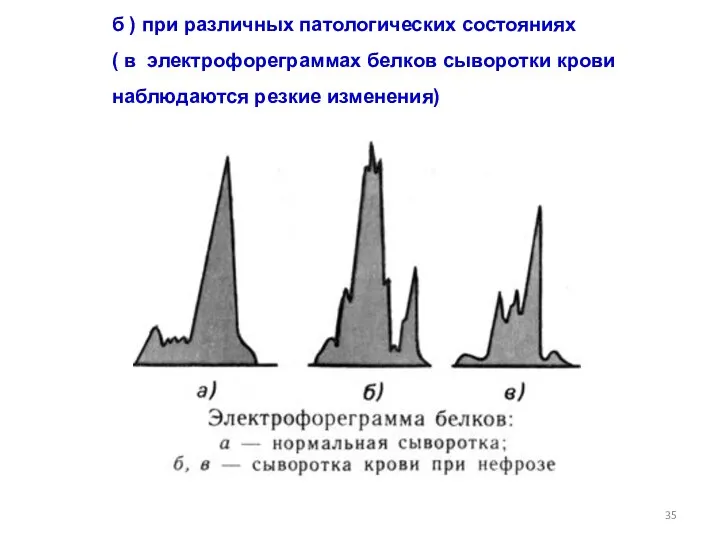
- 35. б ) при различных патологических состояниях ( в электрофореграммах белков сыворотки крови наблюдаются резкие изменения)
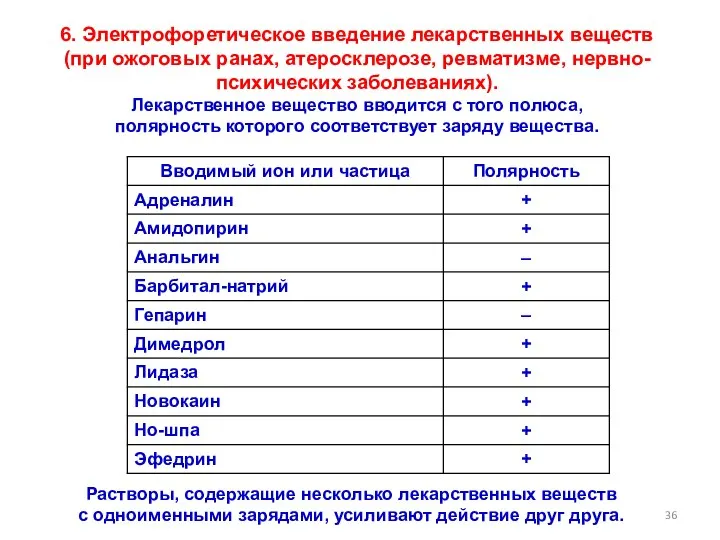
- 36. 6. Электрофоретическое введение лекарственных веществ (при ожоговых ранах, атеросклерозе, ревматизме, нервно-психических заболеваниях). Лекарственное вещество вводится с
- 37. Повышается фармакологическая активность лекарственного вещества: Лекарственное вещество в количествах, в 8-10 раз меньших нормы, дает такой
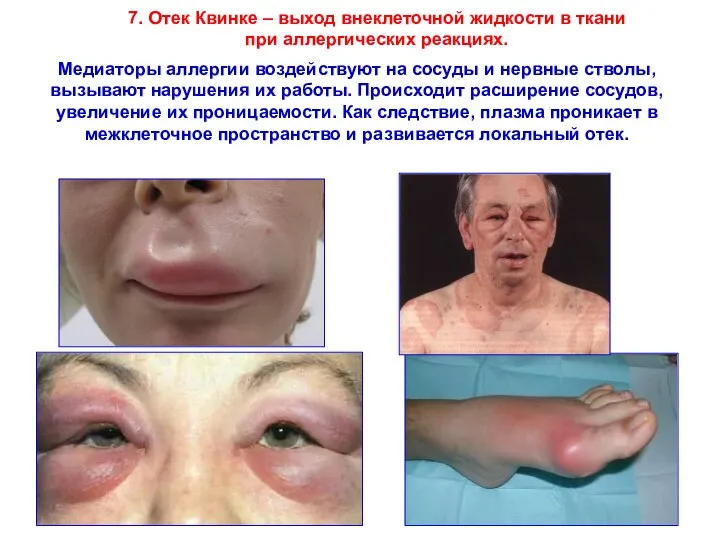
- 38. Медиаторы аллергии воздействуют на сосуды и нервные стволы, вызывают нарушения их работы. Происходит расширение сосудов, увеличение
- 39. Использование в промышленности и народном хозяйстве: для борьбы с топочными дымами при изготовлении посуды, резиновых изделий
- 40. Для понижения уровня грунтовых вод (электроосмос) Схема установки для обезвоживания грунтов методом электроосмоса: 1 – глубинный
- 41. NB!!! При транспортировке жидкого топлива потенциалы протекания и седиментации могут быть причиной пожаров и взрывов.
- 42. Устойчивость и коагуляция коллоидных растворов Устойчивость дисперсных систем - способность сохранять свое состояние и свойства неизмененными
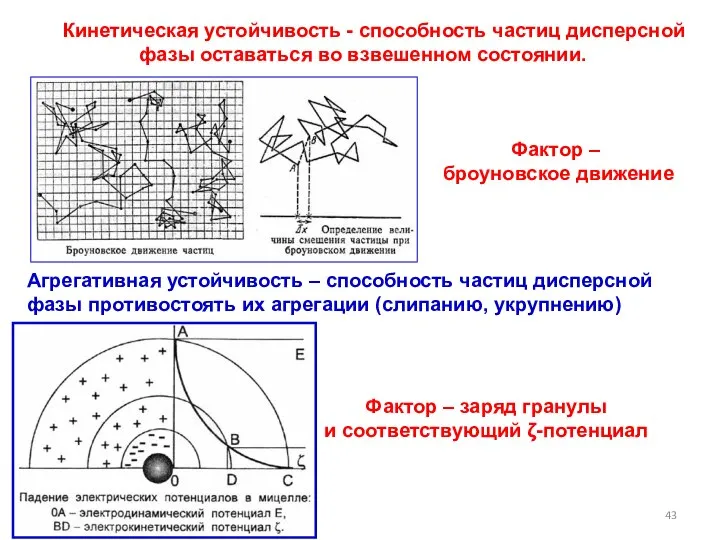
- 43. Агрегативная устойчивость – способность частиц дисперсной фазы противостоять их агрегации (слипанию, укрупнению) Кинетическая устойчивость - способность
- 44. Теория устойчивости гидрофобных дисперсных систем ДФЛО (Б.В. Дерягин, Л.Д.Ландау, Э Фервей, Я. Овербек) Согласно этой теории,
- 45. Теория устойчивости гидрофобных дисперсных систем ДФЛО Энергия притяжения обусловлена силами это Ван-дер-Ваальса и изменяется обратно пропорционально
- 46. Член-корреспондент АН СССР (с 1946). Окончил Московский университет (1922). С 1935 работает в Институте физической химии
- 47. При сближении коллоидных частиц на расстояние 10–9–10–6 м в тонких жидких пленках, разделяющих две твёрдые поверхности
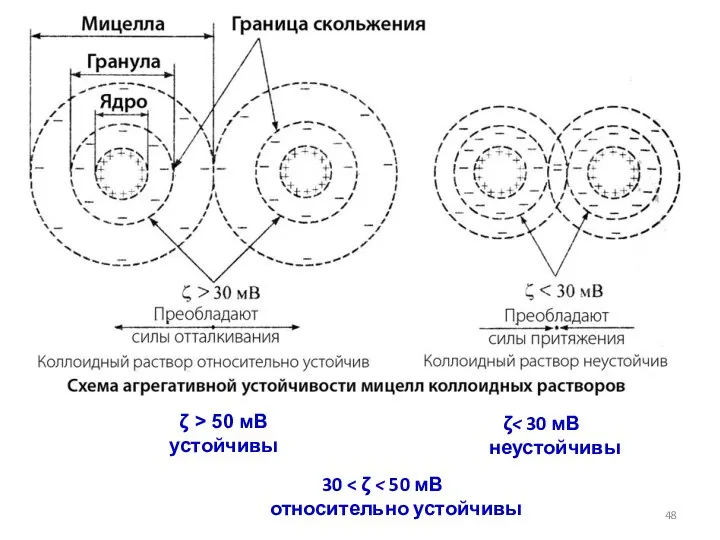
- 48. ζ 30 ζ > 50 мВ устойчивы
- 49. Величина расклинивающего давления зависит от: заряда твердой фазы, толщины диффузного слоя, значения ζ-потенциала Добавки растворов электролитов
- 50. Коагуляция
- 51. Граф логической структуры темы
- 52. Факторы, вызывающие коагуляцию: Добавление электролита. Температура (нагревание и охлаждение); Механическое воздействие; Длительный диализ; Ультрафильтрация; Пропускание электрического
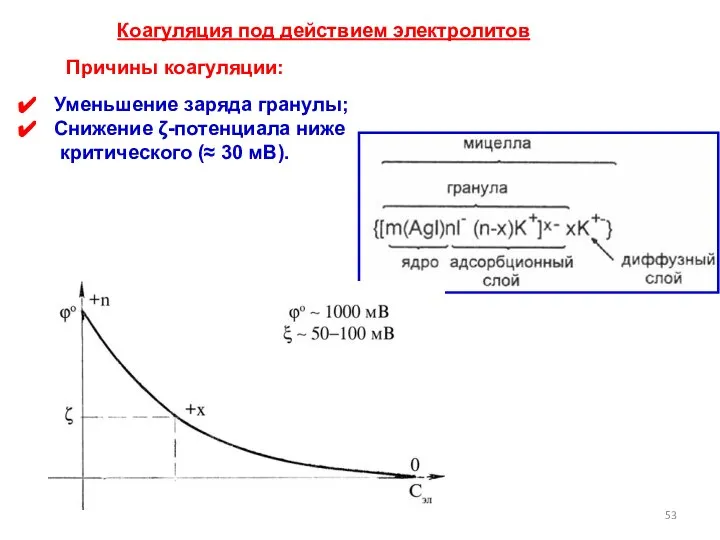
- 53. Уменьшение заряда гранулы; Снижение ζ-потенциала ниже критического (≈ 30 мВ). Причины коагуляции: Коагуляция под действием электролитов
- 54. Зависимость ζ-потенциала от толщины диффузного электрического слоя При добавлении индифферентного электролита уменьшается толщина диффузного слоя, следовательно
- 55. Толщина диффузного слоя рассчитывается по формуле: или
- 56. ζ 30 ζ > 50 мВ устойчивы
- 57. Кинетика коагуляции Кривая скорости коагуляции в зависимости от концентрации электролита Коагуляция под действием электролитов
- 58. Скрытая коагуляция –фиксируется только с помощью приборов, визуально раствор остается прозрачным ζ > 30 мВ Медленная
- 59. Порог коагуляции –количественная оценка коагуляции Порог коагуляции - минимальная концентрация электролита, при которой коагуляция скрытая переходит
- 60. Правило знака и валентности (Шульце-Гарди) Заряда: Коагулирующее действие ионов пропорционально заряду иона-коагулянта в шестой степени: Знака:
- 61. Правило Шульце–Гарди носит приближенный характер. Приготовить золь с абсолютно одинаковыми свойствами невозможно Для катионов К+, Ва2+,
- 62. Задача Пороги коагуляции при добавлении различных электролитов к золю берлинской лазури составили соответственно: Определить знак заряда
- 63. Решение 1. Предположим, что золь заряжен отрицательно. Коагулирующее действие должны оказывать катионы (ионы Na+), т.е. пороги
- 64. Видим, что во втором случае наблюдается достаточно близкое совпадение с правилом Шульце–Гарди. Следовательно, хлорид железа был
- 65. Сu(-) Zn(+) Если же взять избыток гексацианоферрата (II) калия, золь зарядится отрицательно!!!
- 66. Влияние лиотропных рядов Поскольку ионы должны входить в адсорбционный слой, то на коагуляцию действует обратный лиотропный
- 67. Особые случаи коагуляции
- 68. ( неправильные ряды, чередование зон коагуляции ) Явление наблюдается при добавлении многозарядных ионов: Перезярядка золей
- 69. Коагуляция смесью электролитов a1 – аддитивность (CaCl2 + NaCl) а2 – антагонизм (KCl + NaCl) а3
- 70. Аддитивность - это суммирование коагулирующего действия ионов, вызывающих коагуляцию. (коагулирующие ионы не взаимодействуют химически между собой)
- 71. При введении различных лекарственных веществ в организм (в виде инъекций) следует предварительно убедиться в том, что
- 72. При очистке промышленных вод следует учитывать антагонизм вводимых электролитов, препятствующий разрушению коллоидных загрязнений.
- 73. При смешивании двух золей с противоположными зарядами частиц наблюдается взаимная коагуляция. Взаимная коагуляция положительного золя Fe(OH)3
- 74. Строение мицеллы при полной и частичной коагуляции при смешивании разных по заряду золей хлорида серебра {(m
- 75. Привыкание золя - превышение порога коагуляции при добавлении электролита к золю небольшими порциями. Причины: образование пептизатора
- 76. При инъекциях электролита в мышечную ткань или кровь человека необходимо вводить его постепенно, медленно, чтобы не
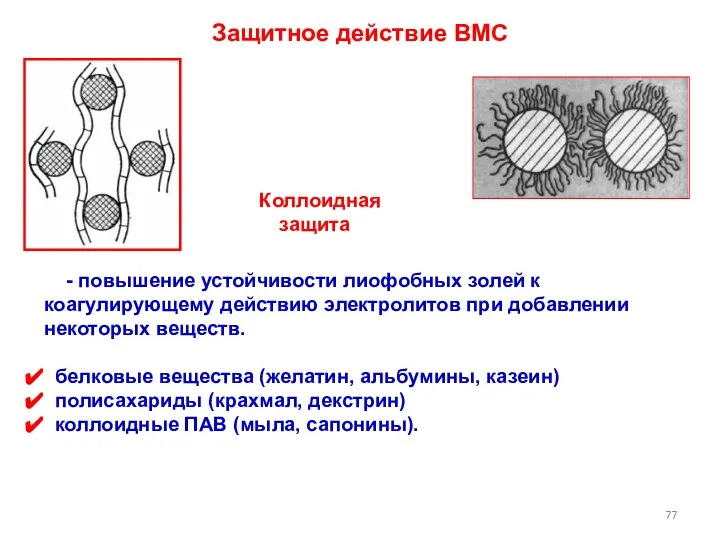
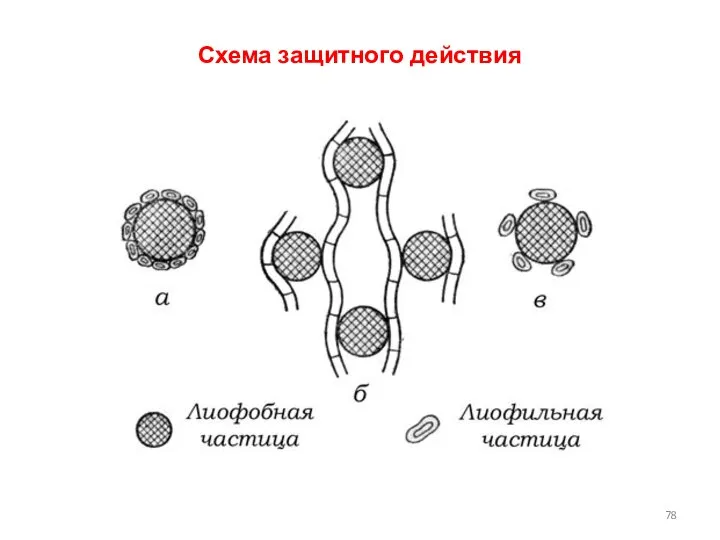
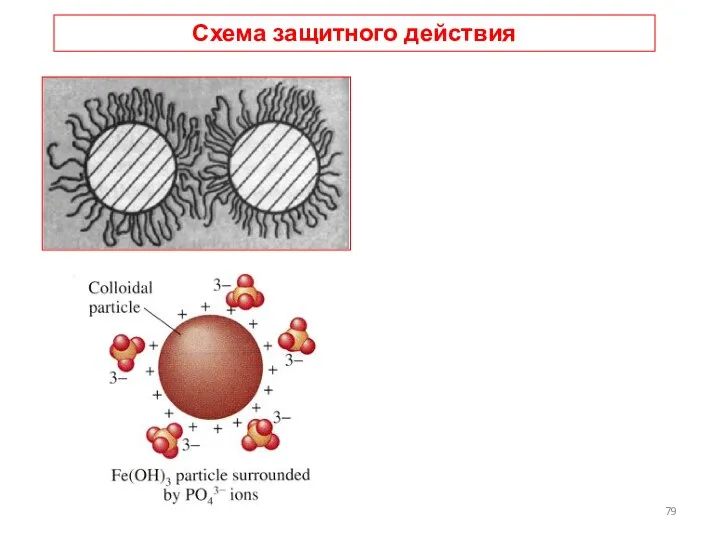
- 77. Защитное действие ВМС Коллоидная защита - повышение устойчивости лиофобных золей к коагулирующему действию электролитов при добавлении
- 78. Схема защитного действия
- 79. Схема защитного действия
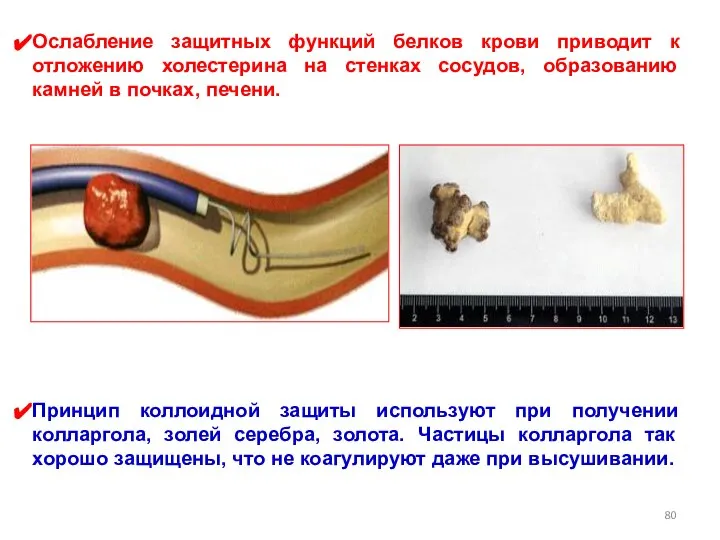
- 80. Ослабление защитных функций белков крови приводит к отложению холестерина на стенках сосудов, образованию камней в почках,
- 81. Золотое число - масса (в мг) сухого ВМС, защищающего 10 мл золя красного золота от коагуляции
- 82. «Золотое» число спинно-мозговой жидкости используют для диагностических целей, ( его значения различны для нормальной спинно-мозговой жидкости
- 83. Сенсибилизация (флокуляция) - агрегирование частиц дисперсной фазы в лиофобных золях и суспензиях под действием небольших количеств
- 84. 1. Учет коагуляции при введении растворов солей в живые организмы (физиологический раствор 0,9 % NaCI нельзя
- 85. Противосвертывающее действие основано на том, что цитрат натрия связывает участвующие в процессе свертывания ионы кальция в
- 86. 4. Коагуляция фосфата кальция и холестерина в крови приводит к склеротическим изменениям сосудов.
- 87. 5. Формирование структуры почв. Образование плодородных дельт в устьях рек Образование плодородной дельты при их слиянии
- 89. Скачать презентацию







































































 Химическая связь
Химическая связь Главная подгруппа IV группы
Главная подгруппа IV группы Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Химическая термодинамика. (Лекция 4)
Химическая термодинамика. (Лекция 4) Методи визначення питомої поверхні
Методи визначення питомої поверхні Анализ ЕГЭ по химии 2011
Анализ ЕГЭ по химии 2011 XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды Фосфор и его соединения
Фосфор и его соединения Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся
Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся  Презентация Воздух, его состав и значение.
Презентация Воздух, его состав и значение.  Гетерофункціональні сполуки. Галогенозамiщенi кислоти
Гетерофункціональні сполуки. Галогенозамiщенi кислоти Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3
Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3 Средние породы
Средние породы Chemistry quiz
Chemistry quiz Физико-химические основы дезодорации растительных масел
Физико-химические основы дезодорации растительных масел Тотығып фосфорлану
Тотығып фосфорлану Хлор
Хлор Презентация Фосфор 9 класс
Презентация Фосфор 9 класс Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Второй закон термодинамики
Второй закон термодинамики Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Термодинамика поверхностных явлений. (Часть 1)
Термодинамика поверхностных явлений. (Часть 1) Бериллий: основные свойства, технологии получения, применение
Бериллий: основные свойства, технологии получения, применение Химические свойства металлов
Химические свойства металлов Коррозия металлов
Коррозия металлов Химические реакции
Химические реакции