Содержание
- 2. Матриксные металлопротеиназы (MMPs) представляют собой семейство Zn- и Са-зависимых Эндо-пептидаз, которые после активации разрушают компоненты внеклеточного
- 3. Семейство цинксодержащих металлопротеиназ в большинстве своём состоит из матриксных металлопротеиназ (ММП). ММП относятся к семейству цинк-зависимых
- 4. История открытия семейства ММП Одно из самых ранних описаний ММП датируется 1949 г. В нем были
- 5. Строение матриксных металлопротеиназ В 1994 г. с помощью рентген-кристаллографии лабораторией Longley были получены 3D структуры каталитических
- 6. Продомен (PRO) Эта структура, которую условно можно разделить на два фрагмента: N-концевую последовательность (сигнальный домен) из
- 7. Каталический Домен Каталитический домен (CAT)Каталитический домен (CAT) состоит примерно из 170 АКО. Включает активный Zn-связывающий сайт
- 8. Шарнирная область Шарнирная область (LINKER)Ещё часто называют линкерный пептид. Его основ- ная задача состоит в том,
- 9. Гемопексиноподобный домен (HPX) (С-концевой) Гемопексиноподобный домен (HPX) образован серией около 200 АКО. Ответственен за специфичность при
- 10. Классификация матриксных металлопротеиназ В 80–90-х годах, когда было охарактеризовано достаточное количество ММП, возникла необходи- мость их
- 11. Механизм активации ММП В 1990 г. было обнаружено, что «цистеиновый вы- ключатель» отвечает за регуляцию фермента
- 12. MMPs при различных заболеваниях
- 13. ММП в стоматологии Матриксные металлопротеиназы (ММП) — это семейство протеолитических ферментов, выделяемых из минерализованного матрикса дентина,
- 16. Скачать презентацию
Матриксные металлопротеиназы (MMPs) представляют собой семейство Zn- и Са-зависимых Эндо-пептидаз, которые
Матриксные металлопротеиназы (MMPs) представляют собой семейство Zn- и Са-зависимых Эндо-пептидаз, которые
Семейство цинксодержащих металлопротеиназ
в большинстве своём состоит из матриксных металлопротеиназ (ММП).
Семейство цинксодержащих металлопротеиназ
в большинстве своём состоит из матриксных металлопротеиназ (ММП).
Своё название они получили из-за способности специфичеcки гидролизовать белки ВКМ.
Они принимают участие в обмене белков соединительной ткани, в процессах нормального развития и ремоделирования клеточного матрикса, эмбриогенезе, репарации тканей, неоангиогенезе, а также в процессах опухолевой трансформации и метастазирования.
Активно изучается роль ММП при ревматоидных артритах, остеоартритах, эндометриозе, аневризмах аорты, периодонтитах, аутоиммунных по- ражениях кожи, атероматозе и язвообразовании
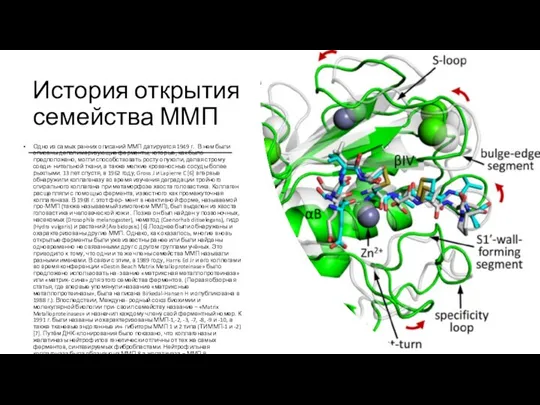
История открытия семейства ММП
Одно из самых ранних описаний ММП датируется 1949
История открытия семейства ММП
Одно из самых ранних описаний ММП датируется 1949
Строение матриксных металлопротеиназ
В 1994 г. с помощью рентген-кристаллографии лабораторией Longley
Строение матриксных металлопротеиназ
В 1994 г. с помощью рентген-кристаллографии лабораторией Longley
Схематическое представление доменной структуры ММП человекаПримечания: Каталитический домен (CAT) с двумя ионами цинка (выделены розовым) и двумя ионами кальция (вы- делены жёлтым). Продомен (PRO) показан тёмно-жёлтым блокирует активный сайт. Линкерный пептид (LINKER) соединяет каталитический и гемопексиноподобный домен (HPX). Некоторые ММП показаны с расширением (EXT) на С-конце, которое не является мембранным якорем. МТ-ММП (МТ-петля) демонстрирует мембранный якорь, который является либо трансмембранной (TM) спиралью с небольшой цитоплазматической частью (CYTO), либо GPI-якорем (GPI). Фибронектиноподобные домены типа II (FIB1-3) показаны зелёным цветом
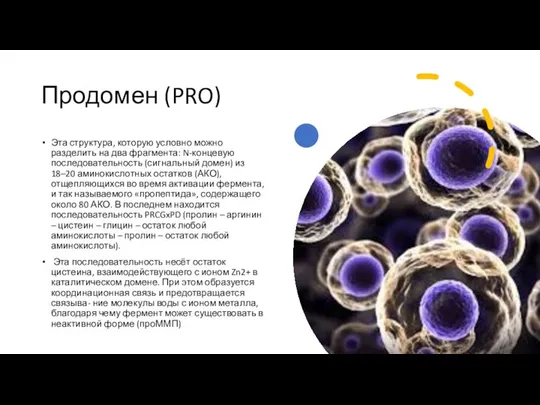
Продомен (PRO)
Эта структура, которую условно можно разделить на два фрагмента: N-концевую
Продомен (PRO)
Эта структура, которую условно можно разделить на два фрагмента: N-концевую
Эта последовательность несёт остаток цистеина, взаимодействующего с ионом Zn2+ в каталитическом домене. При этом образуется координационная связь и предотвращается связыва- ние молекулы воды с ионом металла, благодаря чему фермент может существовать в неактивной форме (проММП)
Каталический Домен
Каталитический домен (CAT)Каталитический домен (CAT) состоит примерно из 170 АКО.
Каталический Домен
Каталитический домен (CAT)Каталитический домен (CAT) состоит примерно из 170 АКО.
Шарнирная область
Шарнирная область (LINKER)Ещё часто называют линкерный пептид. Его основ- ная
Шарнирная область
Шарнирная область (LINKER)Ещё часто называют линкерный пептид. Его основ- ная
Гемопексиноподобный домен (HPX) (С-концевой)
Гемопексиноподобный домен (HPX) образован серией около 200 АКО.
Гемопексиноподобный домен (HPX) (С-концевой)
Гемопексиноподобный домен (HPX) образован серией около 200 АКО.
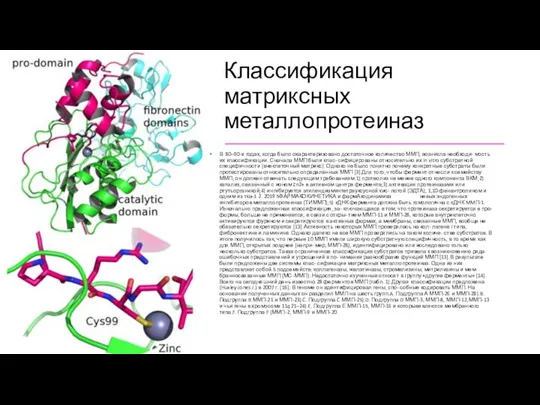
Классификация матриксных металлопротеиназ
В 80–90-х годах, когда было охарактеризовано достаточное количество ММП,
Классификация матриксных металлопротеиназ
В 80–90-х годах, когда было охарактеризовано достаточное количество ММП,
Механизм активации ММП
В 1990 г. было обнаружено, что «цистеиновый вы- ключатель»
Механизм активации ММП
В 1990 г. было обнаружено, что «цистеиновый вы- ключатель»
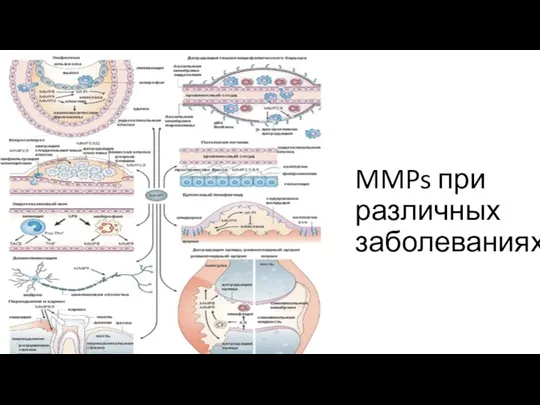
MMPs при различных заболеваниях
MMPs при различных заболеваниях
ММП в стоматологии
Матриксные металлопротеиназы (ММП) — это семейство протеолитических ферментов, выделяемых
ММП в стоматологии
Матриксные металлопротеиназы (ММП) — это семейство протеолитических ферментов, выделяемых









 Химическая связь
Химическая связь Главная подгруппа IV группы
Главная подгруппа IV группы Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Химическая термодинамика. (Лекция 4)
Химическая термодинамика. (Лекция 4) Методи визначення питомої поверхні
Методи визначення питомої поверхні Анализ ЕГЭ по химии 2011
Анализ ЕГЭ по химии 2011 XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды Фосфор и его соединения
Фосфор и его соединения Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся
Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся  Презентация Воздух, его состав и значение.
Презентация Воздух, его состав и значение.  Гетерофункціональні сполуки. Галогенозамiщенi кислоти
Гетерофункціональні сполуки. Галогенозамiщенi кислоти Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3
Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3 Средние породы
Средние породы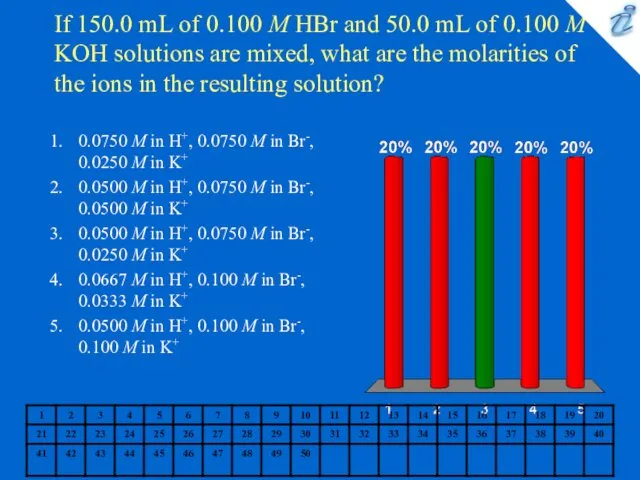 Chemistry quiz
Chemistry quiz Физико-химические основы дезодорации растительных масел
Физико-химические основы дезодорации растительных масел Тотығып фосфорлану
Тотығып фосфорлану Хлор
Хлор Презентация Фосфор 9 класс
Презентация Фосфор 9 класс Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Второй закон термодинамики
Второй закон термодинамики Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Термодинамика поверхностных явлений. (Часть 1)
Термодинамика поверхностных явлений. (Часть 1) Бериллий: основные свойства, технологии получения, применение
Бериллий: основные свойства, технологии получения, применение Химические свойства металлов
Химические свойства металлов Коррозия металлов
Коррозия металлов Химические реакции
Химические реакции