Содержание
- 2. Ли́тий (лат. Lithium; обозначается символом Li) — элемент первой группы (по устаревшей классификации — главной подгруппы
- 3. Литий встречается в природе в виде двух стабильных нуклидов 6Li (7,52% по массе) и 7Li (92,48%).
- 4. Знаете ли вы, ЧТО… … по шкале Мооса твердость Li – 0,6.
- 5. История и происхождение названия Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном
- 6. Иоганн Арфведсон Гемфри Дэви Якоб Берцелиус
- 7. Месторождения Месторождения лития известны в Чили, Боливии (Солончак Уюни — крупнейшее в мире[6]), США, Аргентине, Конго,
- 8. Физические свойства Металл серебристо-белого цвета, самый легкий из металлов, плотность составляет 0,534 г/см3, мягкий (можно резать
- 9. Химические свойства Восстановительные (металлические) свойства усиливаются. 1. Взаимодействие с простыми веществами:
- 10. Литий химически очень активен. Он способен взаимодействовать с кислородом (O) и азотом (N) воздуха при обычных
- 11. 2.Взаимодействие со сложными веществами:
- 12. В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный
- 13. Нахождение в природе Литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10–3%
- 14. Применение: 1. Охладитель в ядерных реакторах. 2. В металлургии для удаления азота, серы и др. примесей.
- 15. Особенности обращения с литием. Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и
- 17. Скачать презентацию














 Спирти. Історична довідка
Спирти. Історична довідка Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Лекция 4. Химическая термодинамика
Лекция 4. Химическая термодинамика Химические свойства металлов. Коррозия металлов
Химические свойства металлов. Коррозия металлов Нефть. Общие сведения
Нефть. Общие сведения Этот многоликий цинк
Этот многоликий цинк Фитотерапия в кардиологии
Фитотерапия в кардиологии Каркасные силикаты
Каркасные силикаты Презентация по Химии "Классификация ядов" - скачать смотреть
Презентация по Химии "Классификация ядов" - скачать смотреть  Вебинар 1.05. Разбор заданий #стольник, #долюшка и #массовая
Вебинар 1.05. Разбор заданий #стольник, #долюшка и #массовая Презентация по Химии "ВЛИЯНИЕ ГАЗИРОВАННЫХ НАПИТКОВ НА ОРГАНИЗМ ЧЕЛОВЕКА" - скачать смотреть
Презентация по Химии "ВЛИЯНИЕ ГАЗИРОВАННЫХ НАПИТКОВ НА ОРГАНИЗМ ЧЕЛОВЕКА" - скачать смотреть  Презентация по Химии "Пластмаси як різновид полімерів" - скачать смотреть бесплатно
Презентация по Химии "Пластмаси як різновид полімерів" - скачать смотреть бесплатно Углеводный обмен. Глюкоза крови
Углеводный обмен. Глюкоза крови Способы количественного определения белка. (Лекция 10)
Способы количественного определения белка. (Лекция 10) Получение, свойства и применение алкенов
Получение, свойства и применение алкенов Презентация по Химии "Нафта і нафтопродукти" - скачать смотреть бесплатно
Презентация по Химии "Нафта і нафтопродукти" - скачать смотреть бесплатно Презентация по Химии "Полімери" - скачать смотреть бесплатно
Презентация по Химии "Полімери" - скачать смотреть бесплатно Органические и неорганические полимеры
Органические и неорганические полимеры Характеристика неметаллов. Галогены
Характеристика неметаллов. Галогены Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ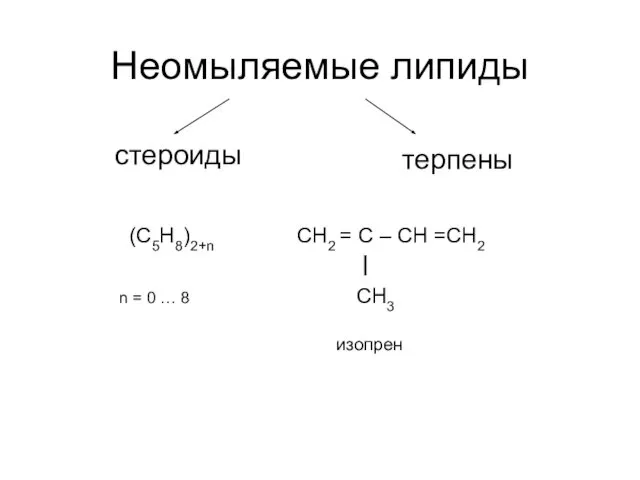 Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Физические методы анализа
Физические методы анализа Использование углеводородов в медицине
Использование углеводородов в медицине Презентация по Химии "Спирти. Хімічні та фізичні властивості спиртів." - скачать смотреть бесплатно
Презентация по Химии "Спирти. Хімічні та фізичні властивості спиртів." - скачать смотреть бесплатно Биологически важные химические элементы. Неорганические соединения
Биологически важные химические элементы. Неорганические соединения Единые смеси
Единые смеси Аттестационная работа. Компьютерная программа оценивания курсовой работы студентов по общей и неорганической химии
Аттестационная работа. Компьютерная программа оценивания курсовой работы студентов по общей и неорганической химии