Содержание
- 2. Взаимное влияние атомов Взаимное влияние атомов в молекуле, ионе, радикале осуществляется под влиянием электронных и пространственных
- 3. Заместители - 04.03.2016 любой атом (кроме водорода), который непосредственно не участвует в реакции, но оказывает влияние
- 4. Электронные эффекты 04.03.2016 Смещение электронной плотности в молекуле, ионе, радикале под влияние заместителей, подразделяются на: -
- 5. Электронодонорные заместители атомная группировка (или атом), повышающая электронную плотность на остальной части молекулы 04.03.2016
- 6. Электроноакцепторные заместители атомная группировка (или атом), понижающая электронную плотность на связанном с ним углеводородном фрагменте 04.03.2016
- 7. Электроноакцепторные заместители Два вида влияний заместителей: индуктивный эффект (±I); мезомерный эффект (±M). В зависимости от смещения
- 8. Индуктивный эффект Передача по цепи сигма-связей электронного влияния заместителей, которое обусловлено различиями в электроотрицательности атомов 04.03.2016
- 9. Индуктивный эффект Направление смещения электронной плотности σ-связей обозначается стрелками и символами частичных зарядов (δ+ или δ-)
- 10. Индуктивный эффект Из-за слабой поляризуемости σ-связей I-эффект быстро ослабевает с удалением заместителя и через 3-4 связи
- 11. -I-эффект Проявляет заместитель, уменьшающий электронную плотность Заместитель приобретает частичный отрицательный заряд, атом углерода – положительный. 04.03.2016
- 12. Определение -I-эффекта 04.03.2016
- 13. +I-эффект Проявляет заместитель, увеличива-ющий электронную плотность Заместитель приобретает частичный положительный заряд, атом углерода – отрицательный. 04.03.2016
- 14. Определение +I-эффекта 04.03.2016
- 15. Мезомерный эффект Передача электронного влияния заместителей по сопряжённой π-системе. Благодаря подвижности π-электронов передаётся по цепи без
- 16. Мезомерный эффект Графически изображают изогнутыми стрелками. В зависимости от направления смещения электронной плотности различают отрицательный (-М)
- 17. Правила определения величины и знака М-эффекта 04.03.2016
- 18. Правило 1. Величина М-эффекта растет с увеличением заряда заместителя. Ионы проявляют наиболее сильный М-эффект: 04.03.2016
- 19. Правило 2 -М-эффект заместителей тем сильнее, чем больше электроотрицательность имеющихся в заместителе элементов: 04.03.2016
- 20. Правило 3 -М-эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия (делокализация электронов), например: 04.03.2016
- 21. Правило 3 Группа С=О в этом случае связана с группировками, +М-эффект которых в ряду O-, NH2,
- 22. Правило 3 В хлорацильной группе -С(О)Cl атом хлора проявляет +М-эффект, однако он значительно слабее -I-эффекта мезомерное
- 23. Правило 4 +М-эффект заместителя тем сильнее, чем меньше электроотрицательность гетероатома, входящего в его состав: 04.03.2016
- 24. Правило 4 Исключение составляют галогены: 04.03.2016
- 25. Правило 4 Причина этого явления заключается в том, что эффективность перекрывания 2р-АО sp2-гибридизованного атома углерода с
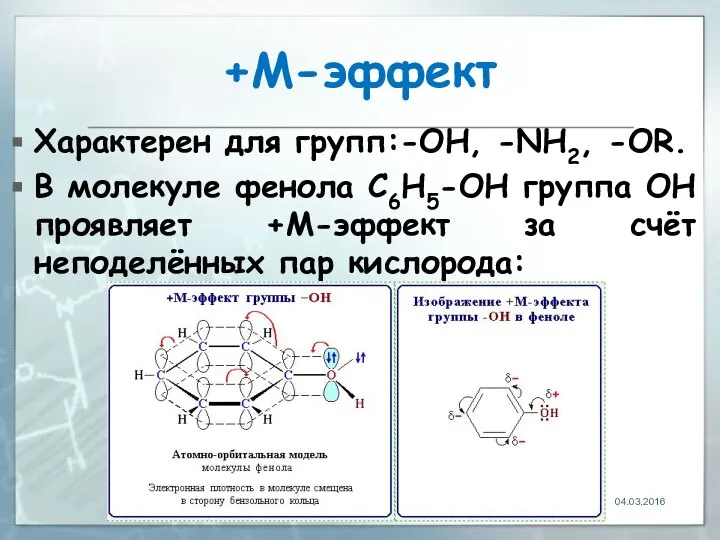
- 26. +М-эффект Характерен для групп:-OH, -NH2, -OR. В молекуле фенола C6H5-OH группа ОН проявляет +М-эффект за счёт
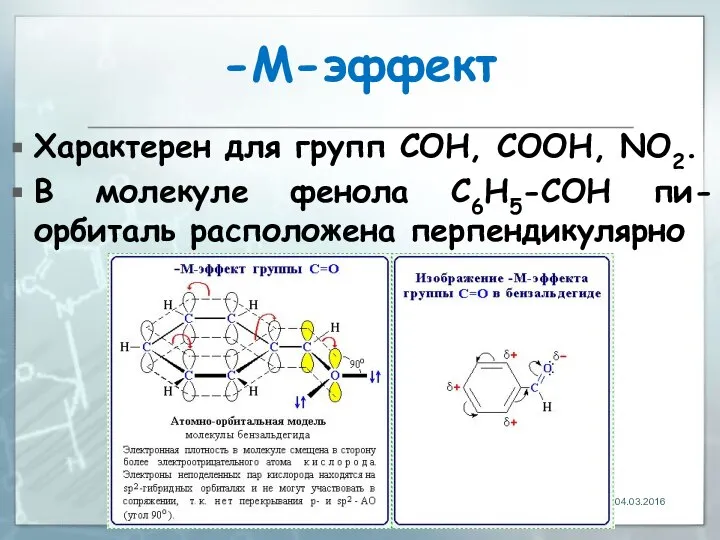
- 27. -М-эффект Характерен для групп СOH, СООН, NО2. В молекуле фенола C6H5-СOH пи-орбиталь расположена перпендикулярно 04.03.2016
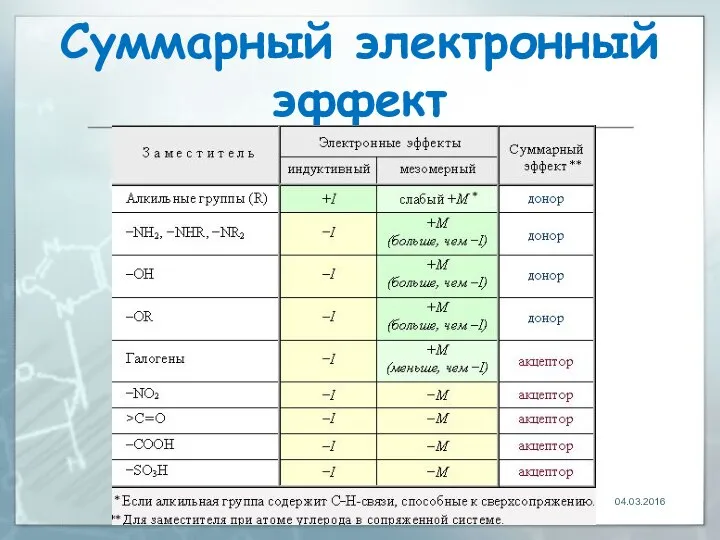
- 28. Суммарный электронный эффект В случае противоположной направленности индуктивного и мезомерного эффектов общее действие заместителя определяется более
- 29. Суммарный электронный эффект в молекуле анилина аминогруппа NH2 одновременно проявляет -I-эффект (за счет большей электроотрицательности атома
- 30. Суммарный электронный эффект аминогруппа является электроно-донорным заместителем, т.к. преобладает более сильный +М-эффект. отрицательный I-эффект относительно слаб:
- 31. Суммарный электронный эффект Аналогичная ситуация (+М > -I) характерна для групп: -NHR, -NR2, -OH, -OR, связанных
- 32. Суммарный электронный эффект В случае галогенов, напротив, преобладает -I-эффект, поскольку, кроме максимально электроотрицательного фтора (очень сильный
- 33. Суммарный электронный эффект 04.03.2016
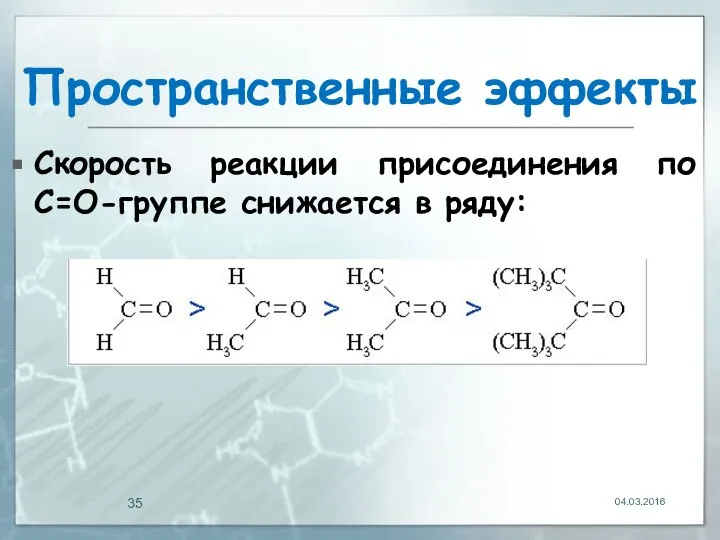
- 34. Пространственные эффекты (стерические) эффекты определяют доступность реакционных центров в молекуле. Объёмные группы могут блокировать центры в
- 35. Пространственные эффекты Скорость реакции присоединения по С=О-группе снижается в ряду: 04.03.2016
- 36. Эффект сверхсопряжения Группа метил CH3 (в меньшей степени, CH2R и СHR2), связанная с sp2 или sp-атомом,
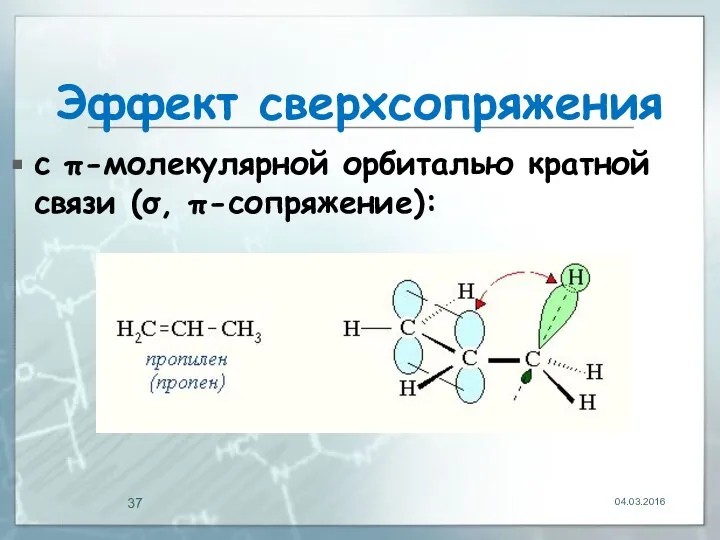
- 37. Эффект сверхсопряжения с π-молекулярной орбиталью кратной связи (σ, π-сопряжение): 04.03.2016
- 38. Эффект сверхсопряжения с р-атомной орбиталью (σ, р-сопряжение): 04.03.2016
- 39. Эффект сверхсопряжения Графически эффект сверхсопряжения обозначается изогнутой стрелкой, охватывающей С-Н связи и направленной в сторону π-связи
- 40. Эффект сверхсопряжения Направление стрелки показывает смещение σ-электронов связи С-Н в сторону кратной связи или р-АО. метильная
- 41. Эффект сверхсопряжения сверхсопряжение является слабым эффектом, но его роль в стабилизации вторичных и, тем более, третичных
- 42. Эффект сверхсопряжения Именно этим фактором, в частности, объясняется увеличение устойчивости свободных радикалов в ряду: 04.03.2016
- 43. Эффект сверхсопряжения В той же последовательности возрастает устойчивость карбокатионов, которая обусловлена как +I-эффектом алкильных групп, так
- 44. Эффект сверхсопряжения Наибольшая стабильность трет-бутил-катиона +C(CH3)3 объясняется не только действием +I-эффекта, но и делокализацией положительного заряда
- 45. 1.Контрольная работа 04.03.2016
- 46. 2. Контрольная работа 04.03.2016 1 2 3 4
- 47. 3.Контрольная работа 04.03.2016
- 48. 4. Контрольная работа 04.03.2016
- 49. 5. Контрольная работа К какому типу органических соединений относится хлоропрен (вещество для получения синтетического каучука): 04.03.2016
- 50. 6. Контрольная работа Функциональной группой фенолов является . . . 04.03.2016 Ответ 1: группа -NH2 Ответ
- 52. Скачать презентацию












































 Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, к
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, к Самоорганизация на межфазных границах, метод Ленгмюра-Блоджетт. Объекты исследования коллоидной химии
Самоорганизация на межфазных границах, метод Ленгмюра-Блоджетт. Объекты исследования коллоидной химии Биохимия крови
Биохимия крови Кольцевые силикаты и их аналоги
Кольцевые силикаты и их аналоги Властивості та застосування полімерів
Властивості та застосування полімерів Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть
Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть  Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии»
Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии» Обобщающий урок по теме «Основные классы неорганических веществ»
Обобщающий урок по теме «Основные классы неорганических веществ» Углеводороды. (Лекция 5)
Углеводороды. (Лекция 5) Презентация по Химии "Насичені вуглеводні. Застосування." - скачать смотреть бесплатно
Презентация по Химии "Насичені вуглеводні. Застосування." - скачать смотреть бесплатно Оксиди
Оксиди Органикалық қосылыстардың
Органикалық қосылыстардың Органический синтез
Органический синтез Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Молярный объём газов
Молярный объём газов Углерод и кремний
Углерод и кремний Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C
Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C Введение в предмет. Классификация композитов
Введение в предмет. Классификация композитов Карбон Карбон (С) або вуглець — хімічний елемент з атомним номером 6. Позначається С, належить до поширених елементів земної кор
Карбон Карбон (С) або вуглець — хімічний елемент з атомним номером 6. Позначається С, належить до поширених елементів земної кор Каталитический крекинг. Промышленные установки
Каталитический крекинг. Промышленные установки An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов Самовосстанавливающиеся материалы
Самовосстанавливающиеся материалы Фосге́н (дихлорангидрид угольной кислоты)
Фосге́н (дихлорангидрид угольной кислоты) Периодический закон Д.И. Менделеева. Химическая связь и ее типы
Периодический закон Д.И. Менделеева. Химическая связь и ее типы Презентация к уроку окружающего мира по теме: ,,Про воздух и про воду” Цель урока: знакомство учеников с богатствами природы - воздухом и водой, их свойствами. Задачи: Продолжить расширение и углубление представлений
Презентация к уроку окружающего мира по теме: ,,Про воздух и про воду” Цель урока: знакомство учеников с богатствами природы - воздухом и водой, их свойствами. Задачи: Продолжить расширение и углубление представлений  Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Органические соединения амины
Органические соединения амины