Содержание
- 3. Периодический закон Д.И. Менделеева
- 4. Случилось в Петербурге это. Профессор университета Писал учебник для студентов… . Задумался невольно он: «Как рассказать
- 5. Мир состоит из элементов. ( в то время знали 60). А сколько их всего? На это
- 6. Д. И. Менделеев (1834 – 1907) 17 февраля (1марта по новому стилю) 1869 г. – открытие
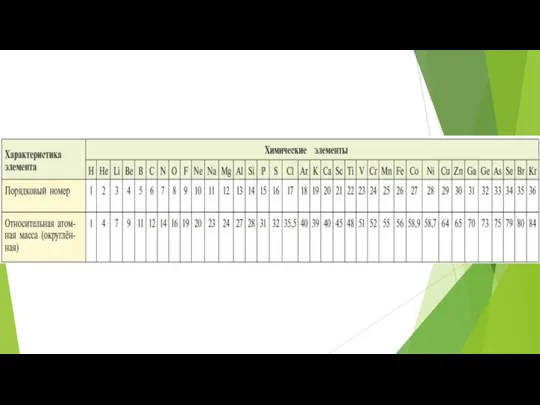
- 7. Периодичность – это повторяемость явления через определенные промежутки времени
- 8. Группы сходных элементов Щелочные металлы: Li, Na, K, Rb, Cs гидроксид ROH Щелочноземельные мtталлы: Ca, Sr,
- 9. Группы сходных элементов Щелочные металлы: Li, Na, K, Rb, Cs гидроксид ROH Щелочноземельные металлы: Ca, Sr,
- 11. С возрастанием атомных масс периодически: ослабевают металлические свойства и усиливаются неметаллические свойства в соединениях с кислородом
- 12. Формулировка периодического закона Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической
- 14. Скачать презентацию










 Наличие 2 х сигналов в ЯМР 1Н (задача)
Наличие 2 х сигналов в ЯМР 1Н (задача) обобщение знаний
обобщение знаний Простой борный суперфосфат
Простой борный суперфосфат Ассортимент и качество изделий из пластмасс (урок 84)
Ассортимент и качество изделий из пластмасс (урок 84) Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Практика по химии
Практика по химии Галогены
Галогены Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.
Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.  Химический состав клетки. Неорганические вещества клетки. Глава 1
Химический состав клетки. Неорганические вещества клетки. Глава 1 Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Технология получения полиуретанов
Технология получения полиуретанов Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Химические реактивы
Химические реактивы Презентация по Химии "Строение атома" - скачать смотреть бесплатно_
Презентация по Химии "Строение атома" - скачать смотреть бесплатно_ Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.
Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А. Машиностроительные материалы
Машиностроительные материалы Углерод и кремний
Углерод и кремний Химическая кинетика. Лекция 2
Химическая кинетика. Лекция 2 Положение в ПСХЭ Д.И.Менделеева и строение атома
Положение в ПСХЭ Д.И.Менделеева и строение атома Рождающий воду
Рождающий воду Химические формулы. Относительные атомная и молекулярная массы. Расчетные задачи
Химические формулы. Относительные атомная и молекулярная массы. Расчетные задачи Особенности строения, реакционной способности и методы синтеза аренов
Особенности строения, реакционной способности и методы синтеза аренов Лекарственное растительное сырье, содержащее алкалоиды
Лекарственное растительное сырье, содержащее алкалоиды Хімія та обмін ліпідів
Хімія та обмін ліпідів Химические свойства металлов
Химические свойства металлов «Аспирин» Выполнила ученица 11 «Б»класса Панина Евгения
«Аспирин» Выполнила ученица 11 «Б»класса Панина Евгения  Органические галогениды. (Лекция 7)
Органические галогениды. (Лекция 7) Кристаллохимия. Тығыз шарлар теориясы
Кристаллохимия. Тығыз шарлар теориясы