Содержание
- 2. «Получение, свойства и применение алкенов» Тема урока:
- 3. Цель урока: рассмотреть различные способы получения алкенов, их физические и химические свойства и применение через работу
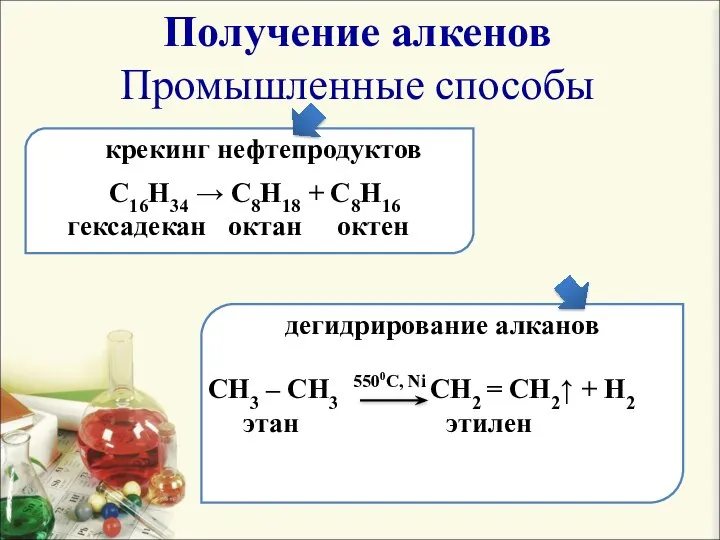
- 4. Получение алкенов Промышленные способы крекинг нефтепродуктов C16H34 → C8H18 + C8H16 гексадекан октан октен дегидрирование алканов
- 5. Получение алкенов Лабораторные способы дегидратация спиртов C2H5OH CH2 = CH2↑ + H2O дегалогенирование дигалогеналканов CH3 –
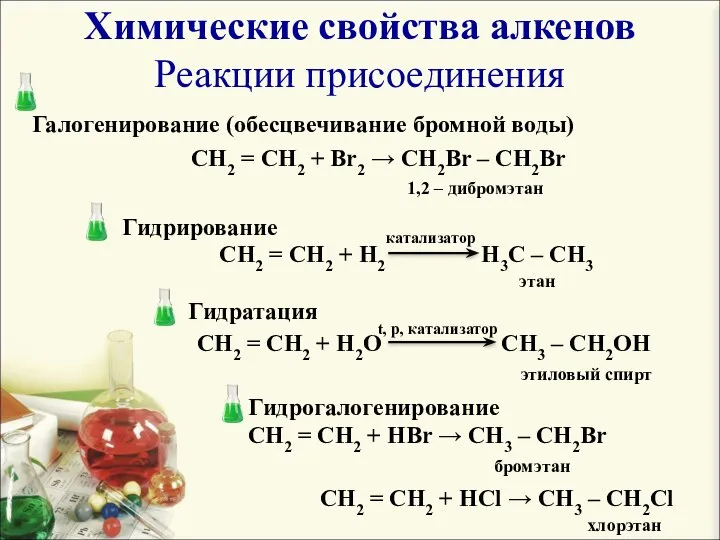
- 6. Химические свойства алкенов Реакции присоединения Галогенирование (обесцвечивание бромной воды) Гидрирование Гидратация Гидрогалогенирование CH2 = CH2 +
- 7. Химические свойства алкенов Реакции окисления Горение на воздухе Мягкое окисление (обесцвечивание раствора KMnO4) Частичное окисление этилена
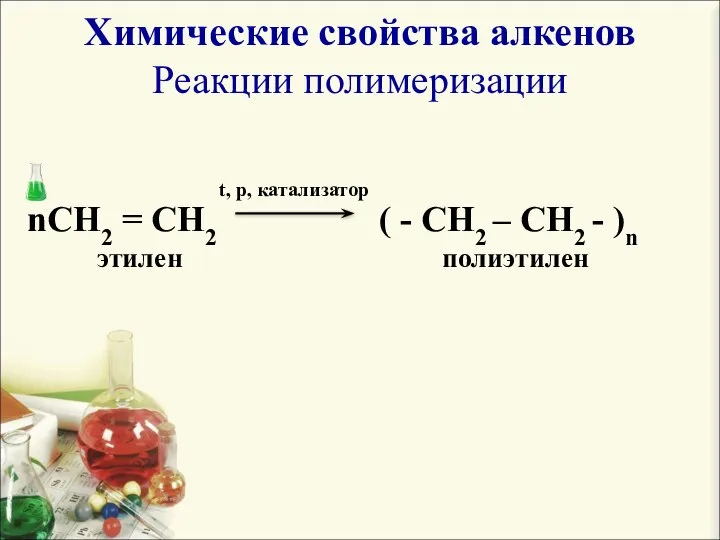
- 8. Химические свойства алкенов Реакции полимеризации
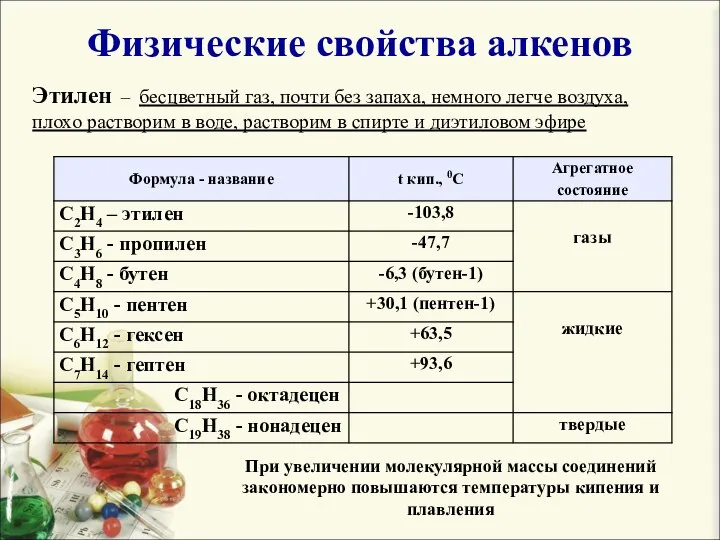
- 9. Физические свойства алкенов Этилен – бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в
- 10. Применение алкенов н. Этилен: исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана, полиэтилена (упаковочная пленка, посуда,
- 11. И для этана, и для этилена характерны: реакции хлорирования; sp3 – гибридизация атомов углерода в молекуле;
- 12. Цель урока: рассмотреть различные способы получения алкенов, их физические и химические свойства и применение через работу
- 13. Урок: Интересно Скучно Безразлично Я на уроке: Работал Отдыхал Помогал другим ИТОГ: Понял материал Узнал больше,
- 15. Скачать презентацию








 Реакционная способность аренов
Реакционная способность аренов Алкадиены. Строение, изомерия, номенклатура, физические и химические свойства
Алкадиены. Строение, изомерия, номенклатура, физические и химические свойства Получение препаратов алкалоидов
Получение препаратов алкалоидов Лекарственные препараты
Лекарственные препараты  Формы нахождения в природе и способы получения простых веществ
Формы нахождения в природе и способы получения простых веществ Химия в мире живописи
Химия в мире живописи Гидролиз
Гидролиз Этилен. Действие этилена на рост проростков гороха
Этилен. Действие этилена на рост проростков гороха Закон сохранения массы веществ
Закон сохранения массы веществ Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Теорія хімічної будови органічних сполук О.М. Бутлерова
Теорія хімічної будови органічних сполук О.М. Бутлерова  Низшие олефины. Методы производства. Направления использования
Низшие олефины. Методы производства. Направления использования Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Биохимическая трансформация веществ (3)
Биохимическая трансформация веществ (3) Индикаторы в нашей жизни
Индикаторы в нашей жизни Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Стеклянные товары. Основные сырьевые материалы для производства стекла
Стеклянные товары. Основные сырьевые материалы для производства стекла Строение электронных оболочек атомов
Строение электронных оболочек атомов Kirish. Geokimyoviy namunalarni tahlil qilish
Kirish. Geokimyoviy namunalarni tahlil qilish Обмен веществ и энергии в клетке
Обмен веществ и энергии в клетке Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Презентация по Химии "Теория нормализации" - скачать смотреть бесплатно
Презентация по Химии "Теория нормализации" - скачать смотреть бесплатно Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Презентация по Химии "Химические тайны запаха" - скачать смотреть
Презентация по Химии "Химические тайны запаха" - скачать смотреть  Сложные эфиры. Жиры
Сложные эфиры. Жиры Белки. Классификация белков. (Тема 2)
Белки. Классификация белков. (Тема 2) Кислотные дожди
Кислотные дожди