Содержание
- 2. Мета́ли ( від грец. μέταλλον — «шахта», «кар'єр», «добування з надр землі») — клас хімічних елементів
- 3. В стародавні часи і в середні віки вважалося, що існує лише сім металів: золото, срібло, мідь,
- 4. Алхіміки вважали, що метали — речовини складні, що складаються з «металічного начала» (ртуті) і «начала горючості»
- 5. Лише в кінці 18 століття А. Л. Лавуазьє спростував гіпотезу флогістону і показав, що метали —
- 6. Будова. Всі метали мають кристалічну будову. Розташовані тим або іншим способом, атоми утворюють елементарну комірку просторової
- 7. Фізичні властивості: Усі метали (за винятком ртуті) при звичайних умовах є кристалічними речовинами. Легкою рухливістю валентних
- 8. Фізичні властивості: За густиною метали умовно поділяють на легкі (густина яких менша 5 г/см3) і важкі
- 9. Хімічні властивості: Характерною особливістю металів є здатність їх атомів віддавати свої валентні електрони і утворювати позитивно
- 10. Хімічні властивості: Сильно активні метали з киснем повітря енергійно взаємодіють вже при звичайній температурі, утворюючи оксиди,
- 11. Хімічні властивості: Більшість металів може безпосередньо реагувати з сіркою, хлором і майже з усіма неметалами, особливо
- 12. Хімічні властивості: Відношення металів до кислот визначається їх місцем в електрохімічному ряду напруг (ряду активності). Усі
- 13. Метали у природі. Метали складають понад 80% усіх хімічних елементів. Переважна більшість металів зустрічається в природі
- 14. Застосування. Конструкційні матеріали. Метали і їх сплави — одні з головних конструкційних матеріалів сучасної цивілізації. Це
- 16. Скачать презентацию













 Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер
Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер Урок № 11 Углекислый газ Цель урока: Систематизировать знания о физических свойствах углекислого газа. Повторить понятия «
Урок № 11 Углекислый газ Цель урока: Систематизировать знания о физических свойствах углекислого газа. Повторить понятия « Презентация по Химии "Полиэтилен" - скачать смотреть
Презентация по Химии "Полиэтилен" - скачать смотреть  Базовое нефтехимическое сырье. Технология каткрекинга
Базовое нефтехимическое сырье. Технология каткрекинга Презентация по Химии "Роль металлов в искусстве" - скачать смотреть
Презентация по Химии "Роль металлов в искусстве" - скачать смотреть  Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Презентация на тему: Кислотные дожди
Презентация на тему: Кислотные дожди Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Глауберова соль
Глауберова соль Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.
Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.  Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Аміни. Метиламін
Аміни. Метиламін Экскурсия по химическому факультету
Экскурсия по химическому факультету Предельные углеводороды
Предельные углеводороды Презентация по Химии "Техника безопасности в кабинете химии" - скачать смотреть
Презентация по Химии "Техника безопасности в кабинете химии" - скачать смотреть  Азот. Физические и химические свойства азота
Азот. Физические и химические свойства азота Гетерофункционалды органикалық қосылыстар
Гетерофункционалды органикалық қосылыстар Производство метанола и этанола
Производство метанола и этанола Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Алюминий и его свойства
Алюминий и его свойства Коррозия металлов
Коррозия металлов Адиабатическое приближение
Адиабатическое приближение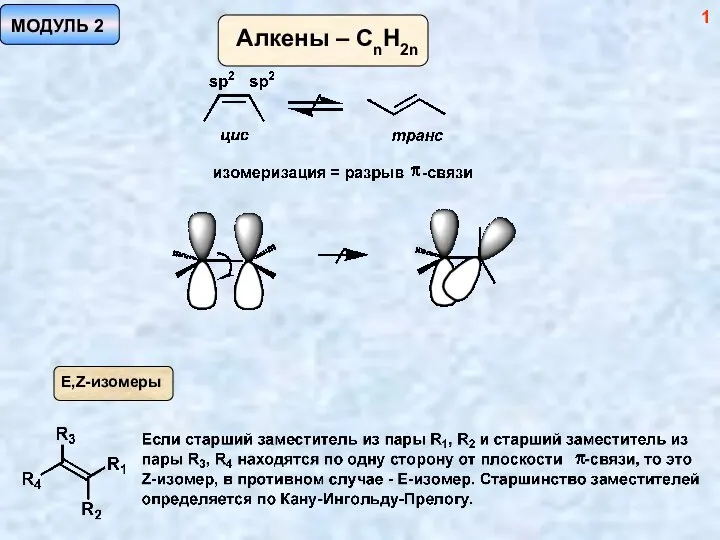 Методы синтеза алкенов. (Модуль 2)
Методы синтеза алкенов. (Модуль 2) Количественные методы анализа риска
Количественные методы анализа риска Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения
Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения Silicates
Silicates Оксиды
Оксиды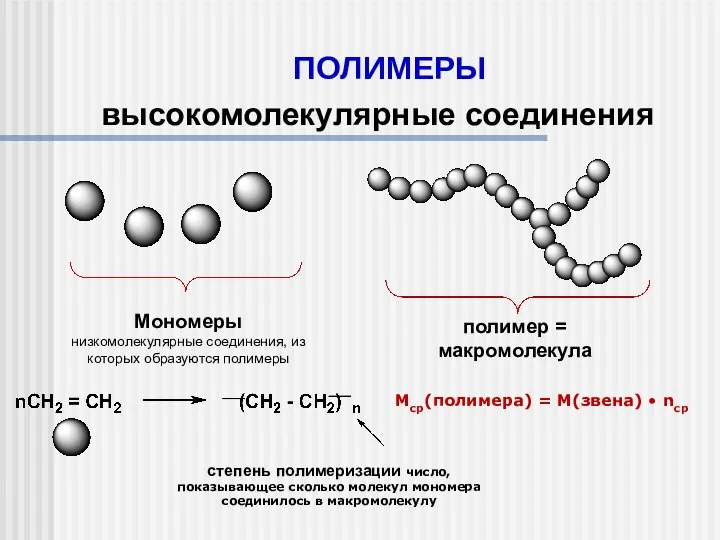 Полимеры. Высокомолекулярные соединения
Полимеры. Высокомолекулярные соединения