Физические свойства спиртов.
Между молекулами спиртов возникают водородные связи это приводит к
тому, что спирты имеют аномально высокие для своей молекулярной массы температуры кипения. По этой же причине, первые представители спиртов являются жидкостями, а не газами. Высшие спирты(начиная с С12Н25ОН) при комнатной температуре- твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и октанол уже не смешивается водой.






 Классификация, виды бензинов и их свойства
Классификация, виды бензинов и их свойства Да здравствует мыло душистое
Да здравствует мыло душистое Химические сдвиги ядер
Химические сдвиги ядер Тема урока: Аммиак
Тема урока: Аммиак Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Гексены. Физические и химические свойства
Гексены. Физические и химические свойства Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин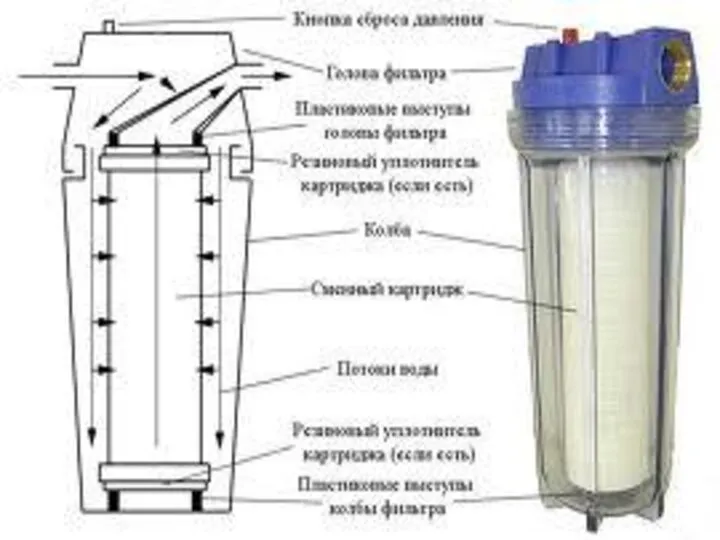 Суды тазарту әдістері
Суды тазарту әдістері Увлекательная химия
Увлекательная химия Органическая химия. Введение
Органическая химия. Введение Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу
Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу Фосфор и его свойства
Фосфор и его свойства Дисперсные системы и растворы
Дисперсные системы и растворы Солюбилизация в прямых мицеллах ПАВ
Солюбилизация в прямых мицеллах ПАВ Угольная кислота и ее соли
Угольная кислота и ее соли Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Застосування амоніаку і солей амонію
Застосування амоніаку і солей амонію  В гостях у Хозяйки Медной горы. Покровская сельская библиотека
В гостях у Хозяйки Медной горы. Покровская сельская библиотека Ненасыщенные углеводороды этиленового ряда
Ненасыщенные углеводороды этиленового ряда Молекулярно-лучевая эпитаксия
Молекулярно-лучевая эпитаксия Презентация по Химии "Типы реакций" - скачать смотреть
Презентация по Химии "Типы реакций" - скачать смотреть  Иондық емес флокулянттар
Иондық емес флокулянттар Химический состав яблока
Химический состав яблока Состав энергетических напитков
Состав энергетических напитков становление органической химии. Выполнила Кириллова Анастасия 2009г.
становление органической химии. Выполнила Кириллова Анастасия 2009г.  Презентация к уроку химии по теме «Спирты» 10 класс. УМК Габриеляна О.С. Базовый уровень
Презентация к уроку химии по теме «Спирты» 10 класс. УМК Габриеляна О.С. Базовый уровень Положение в ПСХЭ Д.И.Менделеева и строение атома
Положение в ПСХЭ Д.И.Менделеева и строение атома Ферум. Залізо. Будова атома, фізичні і хімічні властивості
Ферум. Залізо. Будова атома, фізичні і хімічні властивості