Содержание
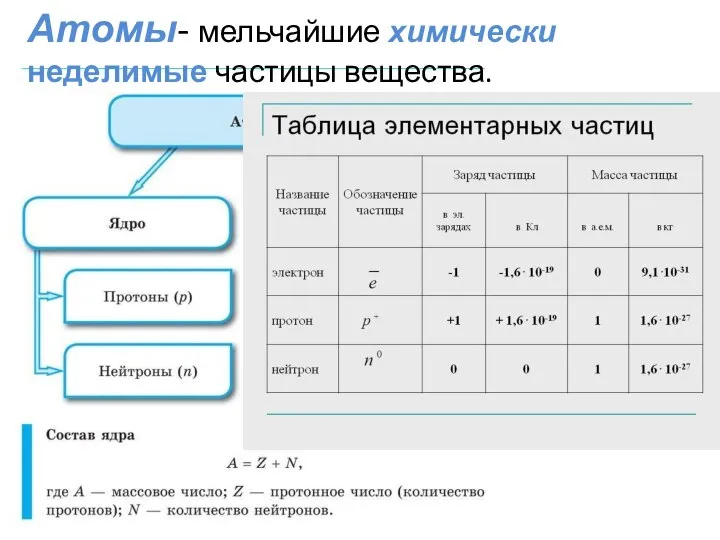
- 2. Атомы- мельчайшие химически неделимые частицы вещества.
- 6. Изотопы водорода Изотоп углерода С14
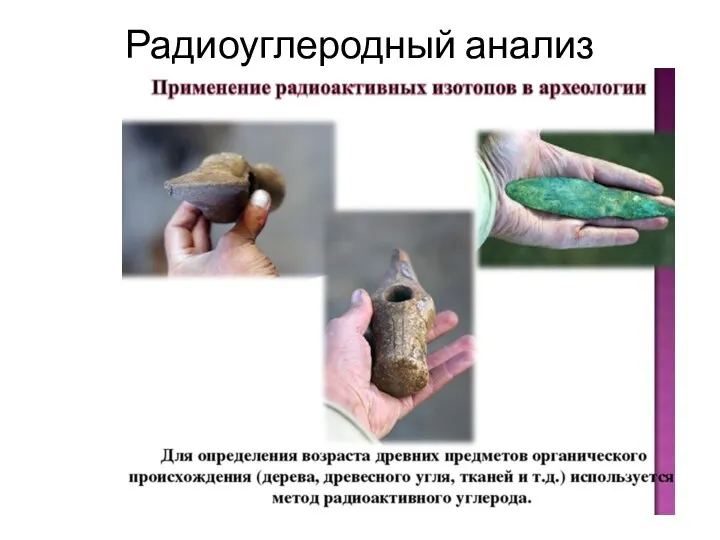
- 7. Радиоуглеродный анализ
- 8. Ошибки метода
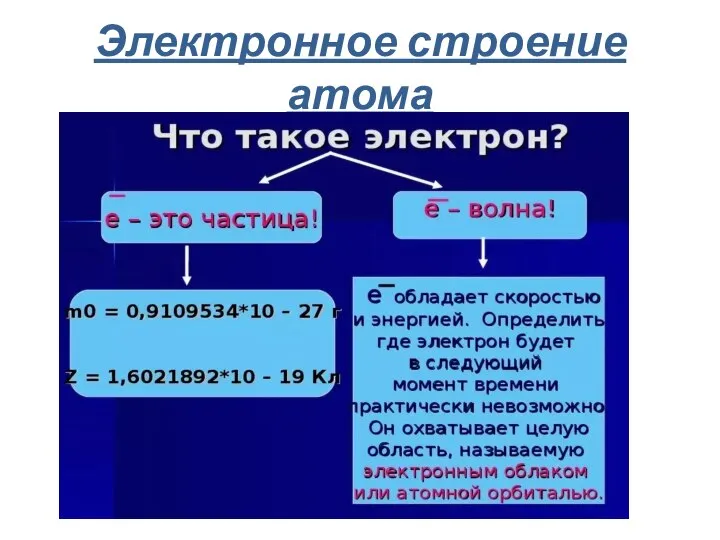
- 9. Электронное строение атома
- 11. Волновая природа электрона
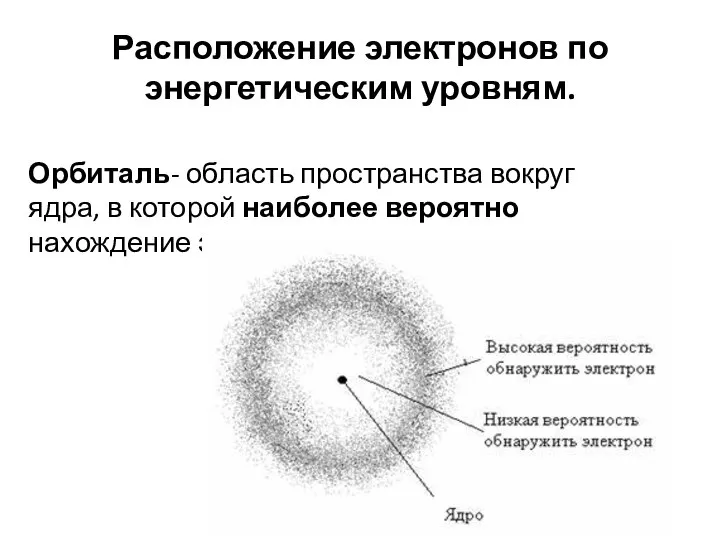
- 12. Расположение электронов по энергетическим уровням. Орбиталь- область пространства вокруг ядра, в которой наиболее вероятно нахождение электрона.
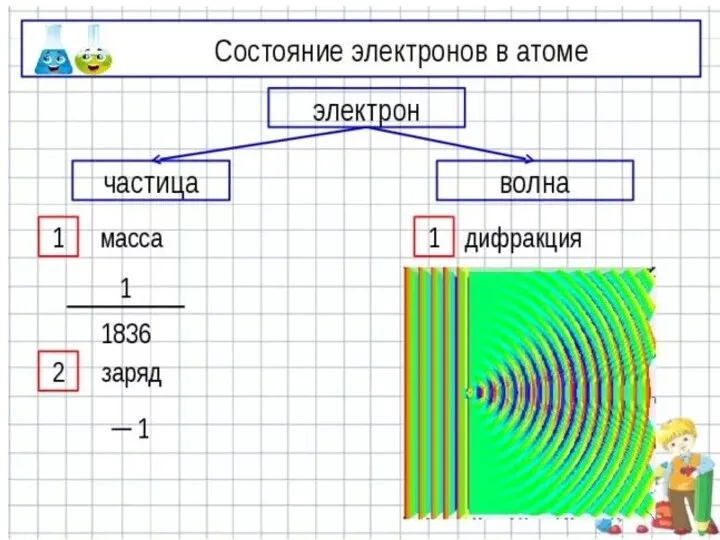
- 13. Состояние электрона в атоме описывает квантовая механика
- 14. Положение электрона в атоме описывается квантовыми числами. n-главное квантовое число (номер энергетического уровня). Значения: 1, 2,
- 21. «Нарушение» этой последовательности
- 22. ПРИЧИНА «ПРОСКОКА» ЭЛЕКТРОНА Считается, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный
- 23. У каких элементов «проскок» электрона
- 25. Д/З 1) Составить электронные формулы атомов элементов в основном состоянии: 2) Выполнить тестовые задания по теме
- 26. Возбуждённое состояние атома и валентные возможности химического элемента Валентность- - число индивидуальных химических связей, которые может
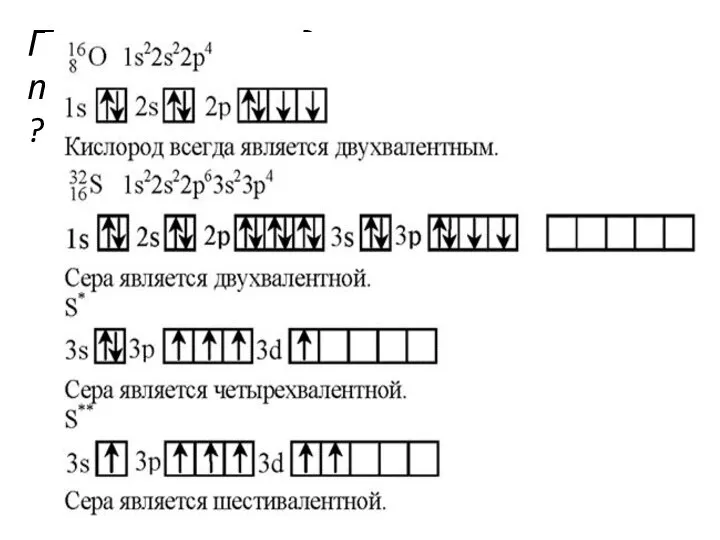
- 27. Почему кислород может проявлять только валентность II, а сера II, IV, VI ?
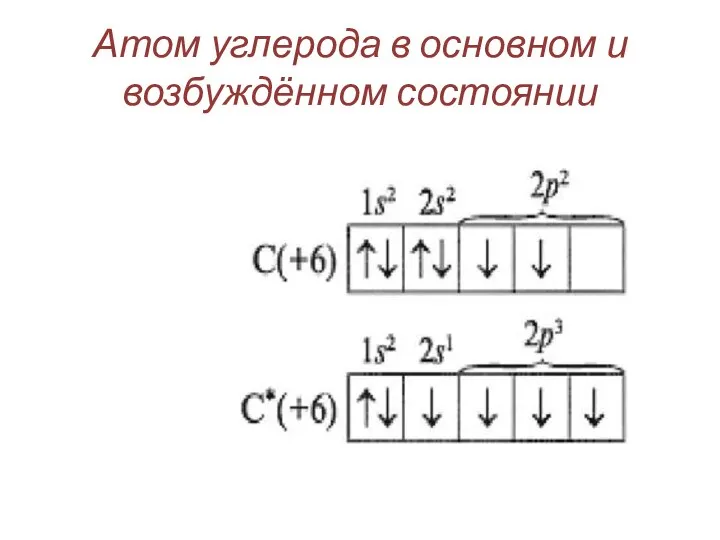
- 32. Атом углерода в основном и возбуждённом состоянии
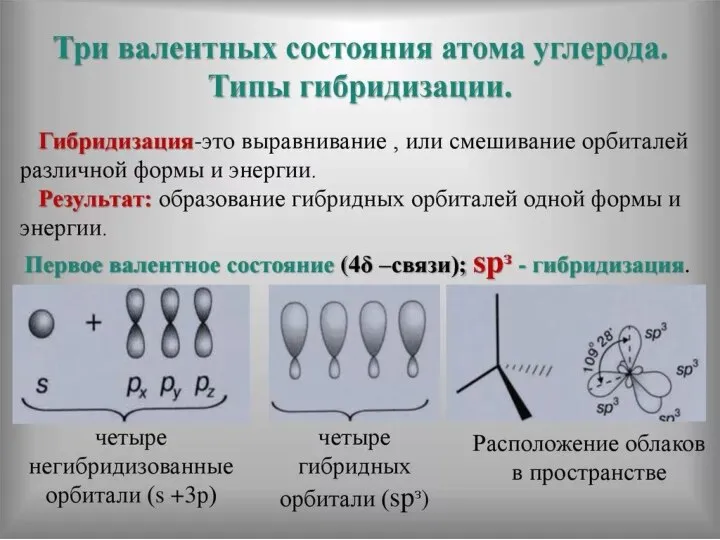
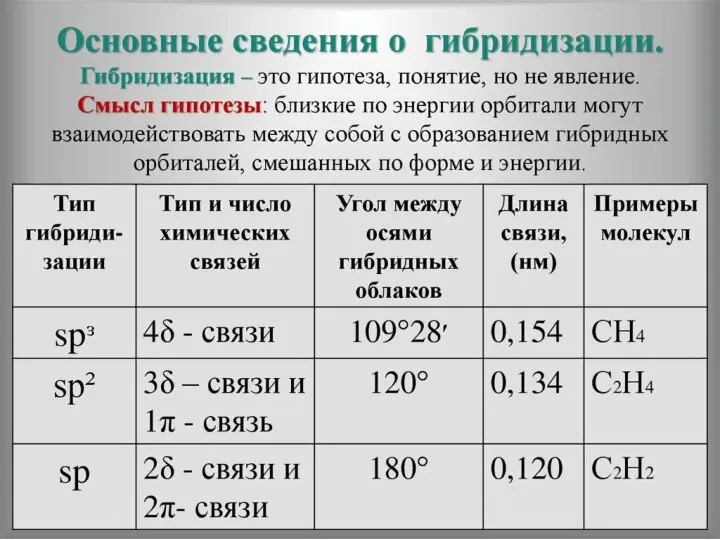
- 33. Теория гибридизации Лайнус Карл Полинг в 1954 году
- 42. ТАБЛИЦА ВАЛЕНТНОСТИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- 43. ЭЛЕМЕНТЫ с ПОСТЯННОЙ ВАЛЕТНОСТЬЮ
- 46. Скачать презентацию


































 Альдегиды и кетоны
Альдегиды и кетоны Презентация по Химии "Белый фосфор" - скачать смотреть
Презентация по Химии "Белый фосфор" - скачать смотреть  Презентация по Химии "строение спиртов, характерные типы химических реакци" - скачать смотреть
Презентация по Химии "строение спиртов, характерные типы химических реакци" - скачать смотреть  Лабораторный штатив
Лабораторный штатив Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер
Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер Токсины в быту. Классификация товаров бытовой химии
Токсины в быту. Классификация товаров бытовой химии Живая химия
Живая химия Использование кинетики в фармации
Использование кинетики в фармации Выявление уровня токсичности почв пришкольного участка и прилежащих к нему территорий
Выявление уровня токсичности почв пришкольного участка и прилежащих к нему территорий ЕГЭ ПО ХИМИИ
ЕГЭ ПО ХИМИИ Аттестационная работа. Образовательная программа элективного курса по химии «Химия и мы»
Аттестационная работа. Образовательная программа элективного курса по химии «Химия и мы»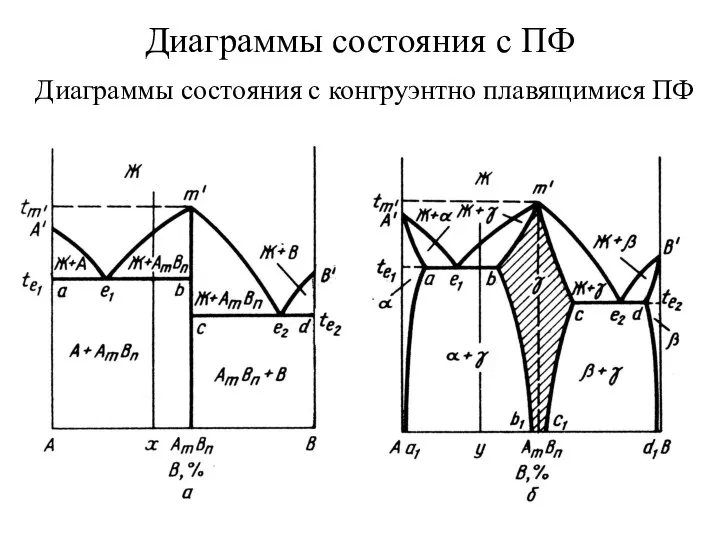 Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ
Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ Биологическая химия
Биологическая химия Ап-конверсионная люминесценция в наностеклокерамике
Ап-конверсионная люминесценция в наностеклокерамике Строение электронных оболочек атомов. (Тема 9)
Строение электронных оболочек атомов. (Тема 9) Стиральные порошки и средства для стирки 2016
Стиральные порошки и средства для стирки 2016 Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей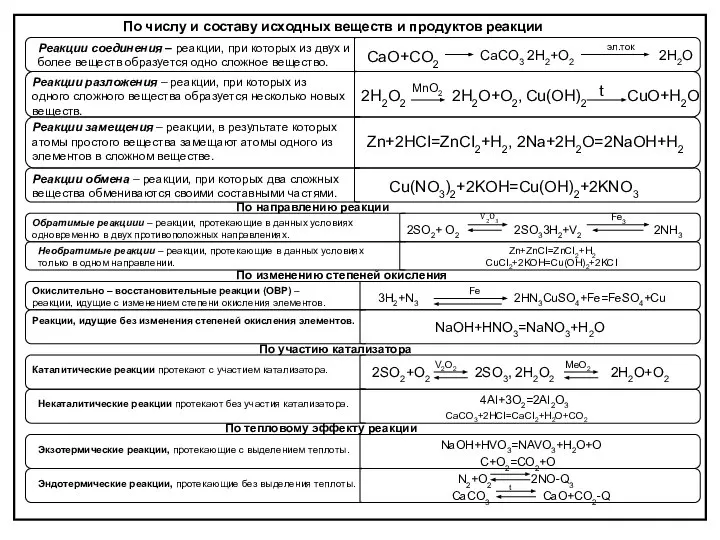 Классификация реакций. Таблица
Классификация реакций. Таблица Електронна природа хімічного зв'язку. Поняття про електронегативність
Електронна природа хімічного зв'язку. Поняття про електронегативність Кинетика химических реакций. (Лекция 12)
Кинетика химических реакций. (Лекция 12) Спирты. Классификация спиртов
Спирты. Классификация спиртов Водород в природе
Водород в природе Фуллерендер құрылымдары және олардың түрлерi
Фуллерендер құрылымдары және олардың түрлерi Химический диктант
Химический диктант Оксиды
Оксиды Оксиды. Классификация
Оксиды. Классификация Игра «Химические элементы» (формулы и названия)
Игра «Химические элементы» (формулы и названия) Аттестационная работа. Методическая разработка защиты проекта по исследовательской работе «Выращивание кристалла»
Аттестационная работа. Методическая разработка защиты проекта по исследовательской работе «Выращивание кристалла»