Содержание
- 2. Нормативные документы, определяющие содержание КИМ ЕГЭ 2022 Содержание КИМ ЕГЭ определяется на основе государственного образовательного стандарта
- 3. Документы, регламентирующие содержание и структуру КИМ ЕГЭ по химии Кодификатор элементов содержания и требований к уровню
- 4. Кодификатор В кодификаторе перечислены элементы содержания курса химии — ведущие понятия, основные закономерности, фактологические сведения о
- 5. Раздел 1. Перечень проверяемых требований к результатам освоения основной образовательной программы среднего общего образования по химии
- 6. Раздел 1. Перечень проверяемых требований к результатам освоения основной образовательной программы среднего общего образования по химии
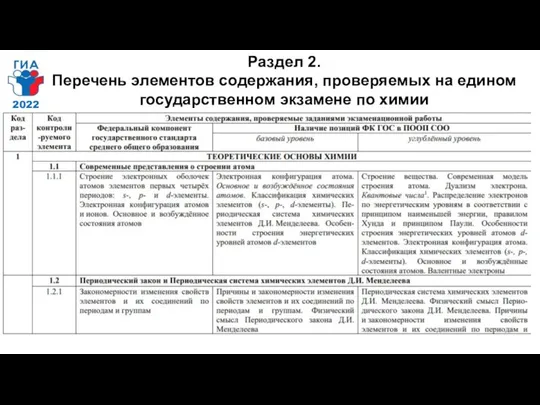
- 7. Раздел 2. Перечень элементов содержания, проверяемых на едином государственном экзамене по химии 2022
- 8. Раздел 2. Перечень элементов содержания, проверяемых на едином государственном экзамене по химии 2022
- 9. Раздел 2. Перечень элементов содержания, проверяемых на едином государственном экзамене по химии 2022
- 10. Спецификация контрольных измерительных материалов для проведения в 2022 году ЕГЭ по химии Содержит информацию о назначении
- 11. Обобщённый план экзаменационного варианта Для каждой позиции в плане указаны: проверяемые элементы содержания и их коды
- 12. Демонстрационный вариант 2022 г. Позволяет получить представление о том, сколько заданий в экзаменационном варианте, какие виды
- 13. Демонстрационный вариант 2022 г. В демонстрационном варианте представлены конкретные примеры заданий, не исчерпывающие всего многообразия возможных
- 14. Структура КИМ 2021
- 15. Подходы к отбору содержания заданий части 2 значимость проверяемого материала для общеобразовательной подготовки выпускников средней школы;
- 16. Особенности заданий части 2 КИМ ЕГЭ по химии В системе КИМ ЕГЭ заданиям с развёрнутым ответом
- 17. Направленность заданий с развёрнутым ответом Выполнение заданий с развернутым ответом требует от выпускника: прочных системных теоретических
- 18. Задания с развёрнутым ответом проверяют умения: 2022 – объяснять обусловленность свойств и применения веществ их составом
- 19. Инструкция перед критериями оценивания части 2 При наличии уравнений химических реакций, отражающих дополнительные/альтернативные химические превращения, не
- 20. Оценивание заданий с РО По результатам первой и второй проверок эксперты независимо друг от друга выставляют
- 21. Особенности работы экспертов ПК при проверке ответов экзаменуемых При проверке заданий с РО эксперт руководствуется стандартизированными
- 22. Основные компоненты в работе экспертов, влияющие на процент расхождений при оценивании ответов выпускников умение работать по
- 23. Задание 29 Условие задания предполагает отбор веществ из приведенного перечня, составление молекулярного уравнения ОВР и электронного
- 24. Задание 29
- 25. Рекомендации по оцениванию отдельных элементов ответа и решению возможных проблем при оценивании: в качестве исходных веществ
- 27. Критерии оценивания задания 29
- 28. Задание 29 Ставится 1 балл за элемент 2 ответа при условии, если: правильно указаны степени окисления
- 29. : KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O KMnO4 + Na2SO3 +
- 30. Запись электронного баланса K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + … 2Cr+6 +
- 31. Такие обозначения степеней окисления как N5+ и N4+ (сначала цифра, затем знак) считаются неверными. Исключение: у
- 32. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций степень окисления 0 может не указываться экзаменуемым;
- 33. Примечание 1: Если допущены грубые ошибки в составлении уравнения реакции: использованы вещества не из предложенного перечня,
- 34. Пример 1 Задание 29 Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид серебра(I), азотная
- 35. Пример 1а 2
- 36. Пример 1б
- 37. Пример 1в
- 38. Пример 1г Задание 29 Задание 29
- 39. Задание 30
- 40. Ионные уравнения реакций отражают суть тех изменений, которые происходят при взаимодействии веществ − электролитов Реакции в
- 41. Степень диссоциации слабых электролитов в разбавленных водных растворах не превышает, как правило, 10-20%, например: Задание 30
- 42. Реакции образования гидроксокомплексов при взаимодействии растворов щелочей и растворимых солей цинка и алюминия также можно отнести
- 43. Некоторые особые случаи Кислые соли диссоциируют ступенчато, например: NaHSO3 → Na+ + HSO−3 (первая ступень) 3
- 44. Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид серебра(I), азотная кислота, перманганат калия, сульфат
- 45. Пример 11
- 46. Задание 31 В модель задания 31, проверяющего сформированность умения составлять уравнения реакций отражающих взаимосвязь веществ различных
- 47. © все пр Элементы содержания, проверяемые заданием
- 48. Необходимо проявить умение составлять уравнения реакций, соответствующих всем типам взаимодействия неорганических веществ: кислотно-основное взаимодействие; реакции ионного
- 50. Выдержки из «Рекомендации по оцениванию отдельных элементов ответа…» Каждый из четырёх элементов ответа считать верным если:
- 51. Нитрат меди (II) прокалили. Образовавшуюся при этом смесь газов пропустили через воду, при этом образовалась кислота.
- 55. © все права защищены
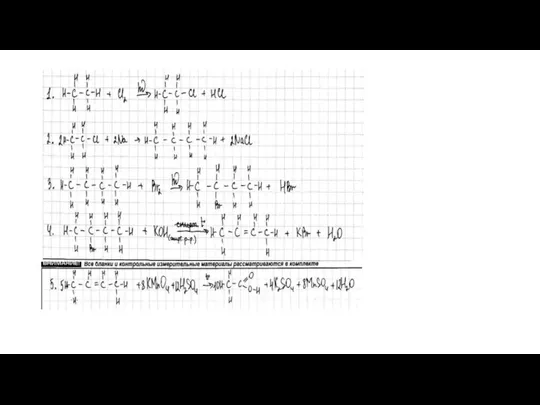
- 57. Задание 32 В формулировку задания 32, направленного на проверку сформированности умения составлять уравнения реакций, отражающих взаимосвязь
- 58. Задание 32 Проверяемые ведущие элементы содержания генетическая взаимосвязь органических веществ характерные химические свойства органических веществ различных
- 59. Каждый из пяти элементов ответа считать верным если: правильно записаны все формулы веществ − участников реакции;
- 60. Допустимо использование молекулярных формул для простейших представителей гомологических рядов: CH4, C2H2, C6H6, C2H5OH, CH2O, С6Н12О6 и
- 61. Задание 32 X1 X2 KMnO4, H2SO4, t° Br2, h X3 X4 этан 2-бромбутан KOH (спирт. р-р),
- 68. Задание 33 Предусматривает проверку умений осуществлять следующие виды расчетов: Расчёты с использованием понятий «растворимость», «массовая доля
- 69. • в ответе правильно записаны все уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в
- 70. Рекомендации по оцениванию отдельных элементов ответа и решению возможных проблемных ситуаций 1. Ставится 1 балл за
- 71. Ставится 1 балл за наличие в ответе правильно произведённых вычислений, в которых используются необходимые физические величины,
- 72. 4. Ставится 1 балл, если в ответе экзаменуемого в соответствии с условием задания определена искомая физическая
- 73. При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использовать свой алгоритм решения
- 74. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. Насыщенный раствор,
- 75. CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl CaCl2 + 2AgNO3 = 2AgCl↓+ Ca(NO3)2 Рассчитаны количество вещества
- 90. Задание 34 Задание 34 предусматривает проверку умения находить молекулярную и структурную формулу органического вещества. Знание свойств
- 91. Ответ правильный и полный: правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная
- 92. Ставится 1 балл за определение молекулярной формулы вещества на основании приведённых необходимых правильных вычислений. Ответ должен
- 93. 3. Ставится 1 балл при наличии записи уравнения реакции, на которую даётся указание в условии задания:
- 94. Органическое вещество содержит 3,41% водорода, 34,09% углерода, 36,36% кислорода и 26,14% натрия по массе. Известно, что
- 95. NaO C CH2 CH2 CH2 C + 2NaOH H3C CH2 CH3 ONa + 2Na2CO3 Общая формула
- 99. Скачать презентацию


















































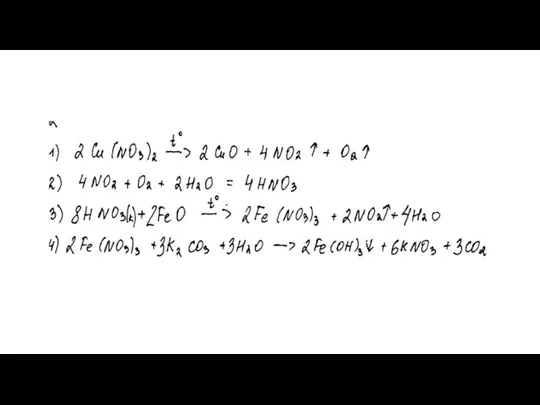











































 Химический элемент алюминий
Химический элемент алюминий Соли. Классификация
Соли. Классификация Углеводы (сахариды)
Углеводы (сахариды) Физические и химические явления
Физические и химические явления Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Декарбонизаторы. Декарбонизация
Декарбонизаторы. Декарбонизация Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот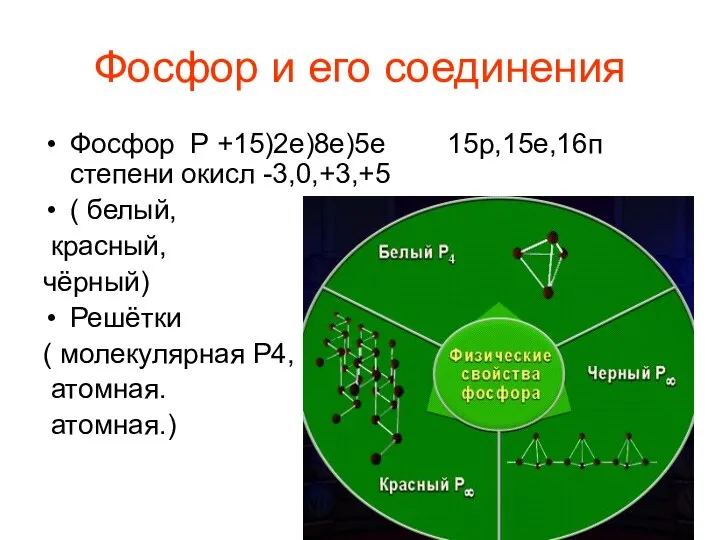 Фосфор и его соединения Фосфор Р +15)2е)8е)5е 15р,15е,16п степени окисл -3,0,+3,+5 ( белый, красный, чёрный) Решётки ( молекулярная Р4,
Фосфор и его соединения Фосфор Р +15)2е)8е)5е 15р,15е,16п степени окисл -3,0,+3,+5 ( белый, красный, чёрный) Решётки ( молекулярная Р4,  Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Сложные эфиры Урок химии в 10 классе
Сложные эфиры Урок химии в 10 классе The phenomenon of radioactivity. Radioisotopes. The nuclear reaction
The phenomenon of radioactivity. Radioisotopes. The nuclear reaction Геометрия молекул
Геометрия молекул Алкены. Пропилен
Алкены. Пропилен Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Технология оптического стекла
Технология оптического стекла Лактоза
Лактоза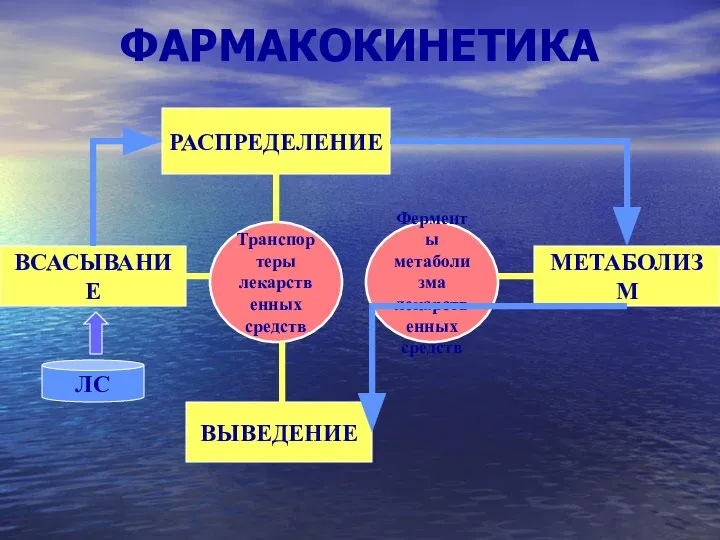 Фармакокинетика
Фармакокинетика Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Оксиды углероды
Оксиды углероды Рідкі кристали
Рідкі кристали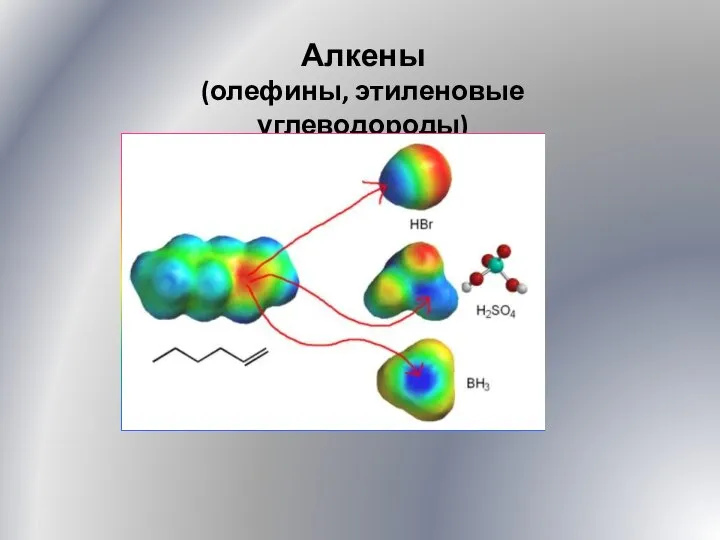 Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) Протолитическая теория кислот и оснований
Протолитическая теория кислот и оснований Натуральный комплекс минералов
Натуральный комплекс минералов Алюминий и его соединения
Алюминий и его соединения Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Химия морской воды
Химия морской воды