Содержание
- 3. Качественная реакция на кратные связи – обесцвечивание бромной воды и разбавленного щелочного раствора KMnO4 Физическими методами
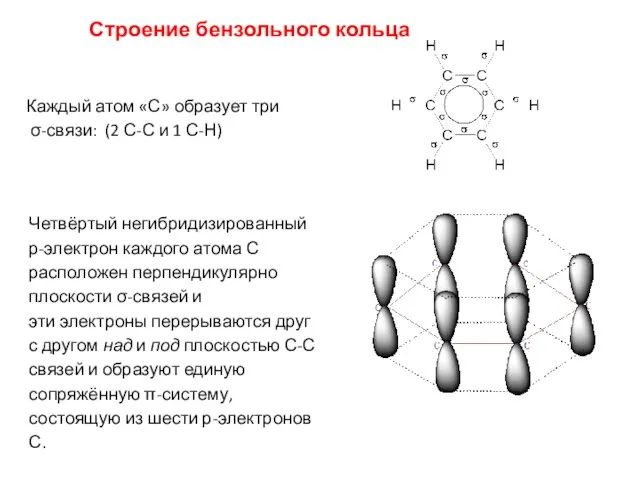
- 4. Строение бензольного кольца Каждый атом «С» образует три σ-связи: (2 С-С и 1 С-Н) Четвёртый негибридизированный
- 5. Сочетание шести σ-связей с единой π-системой кольца, называется ароматической связью. Цикл из шести атомов углерода, связанных
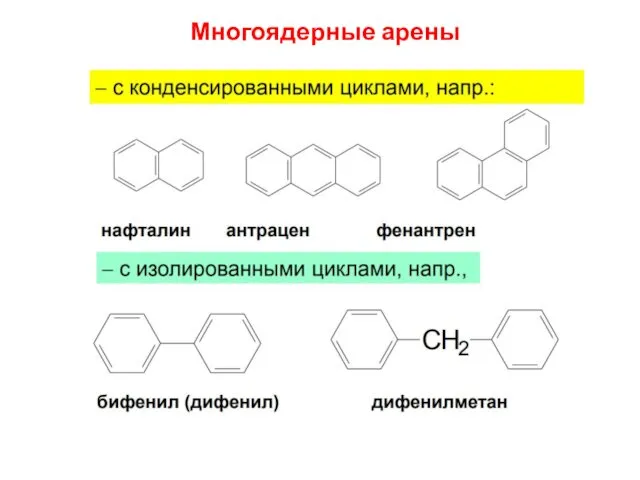
- 7. Многоядерные арены
- 8. Одноядерные ароматические соединения Гомологический ряд
- 9. Изомерия
- 12. Химические свойства бензола Ароматическая связь определяет свойства бензола. 6 π-электронная система является более устойчивой, чем обычные
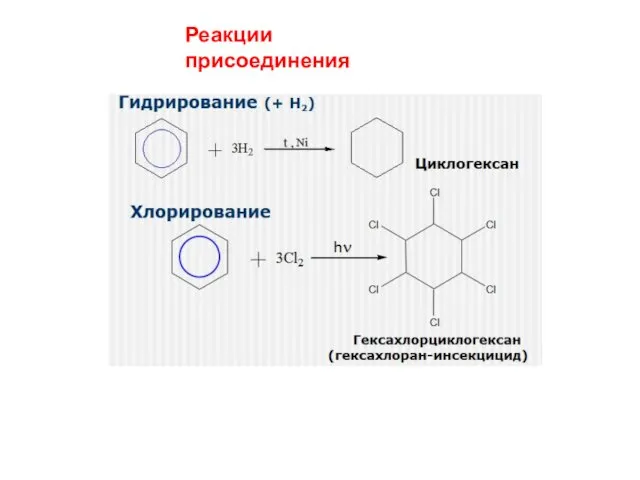
- 14. Реакции присоединения
- 15. Правила ориентации в бензольном кольце Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной
- 16. Положительный индуктивный эффект (+ I) проявляют элементы менее электроотрицательные, чем C; группы с отрицательным зарядом.
- 17. –М-эффект - заместители, содержащие электроотрицательные атомы и понижающие электронную плотность в сопряженной системе: >C=O, –COOH, –COOR,
- 18. В молекуле бензола p -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Введение
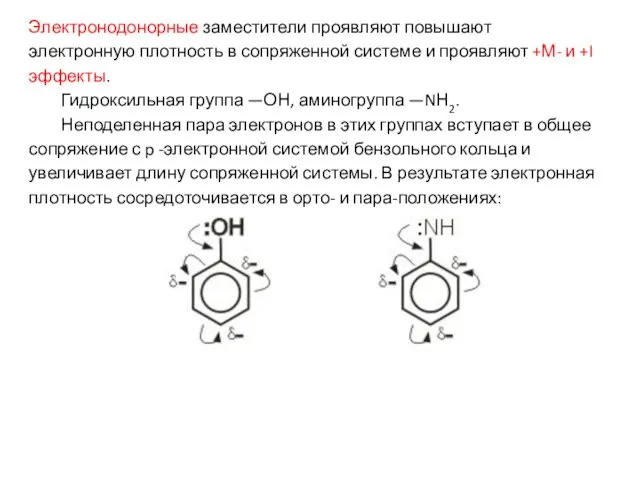
- 19. Электронодонорные заместители проявляют повышают электронную плотность в сопряженной системе и проявляют +М- и +I эффекты. Гидроксильная
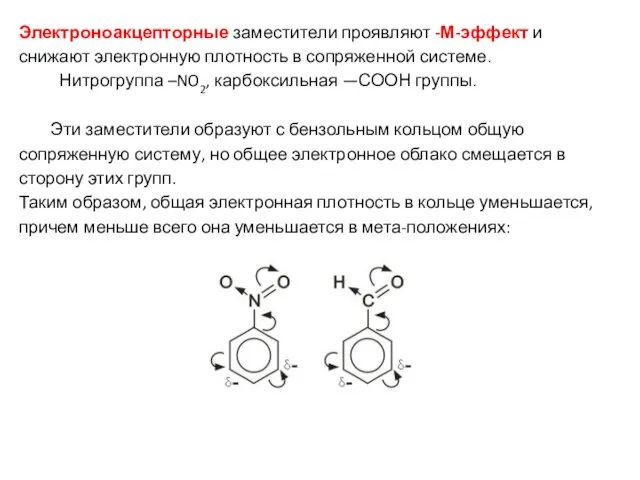
- 20. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. Нитрогруппа –NO2, карбоксильная —СООН группы.
- 21. Помимо ориентирующего действия, заместители оказывают влияние и на реакционную способность бензольного кольца: - ориентанты 1-го рода
- 24. Скачать презентацию
















 Группа рассеянных химических элементов
Группа рассеянных химических элементов Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Фармакология, её задачи. Этапы развития. Краткий очерк истории отечественной фармакологии
Фармакология, её задачи. Этапы развития. Краткий очерк истории отечественной фармакологии Штучні волокна Підготували учениці 7(11) – А класу Єзерська В., Крамарук М.
Штучні волокна Підготували учениці 7(11) – А класу Єзерська В., Крамарук М.  Лекарственные препараты
Лекарственные препараты  Фазовые диаграммы с протеканием 3-фазных реакций
Фазовые диаграммы с протеканием 3-фазных реакций Основные понятия и законы химии
Основные понятия и законы химии Кобаламины(витамин В12) антианемический
Кобаламины(витамин В12) антианемический Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Лабораторная посуда и оборудование
Лабораторная посуда и оборудование Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Общая характеристика аргона
Общая характеристика аргона Кремний и его соединения
Кремний и его соединения Органическое часть почвы
Органическое часть почвы Статистическая обработка результатов химического анализа. Методы аналитической химии
Статистическая обработка результатов химического анализа. Методы аналитической химии Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Презентация Теллур
Презентация Теллур Формулы. Химия
Формулы. Химия Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10)
Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10) Закон сохранения массы веществ Омельянчук Т.Е. учитель химии МАОУ ДСОШ №2 г. Домодедово
Закон сохранения массы веществ Омельянчук Т.Е. учитель химии МАОУ ДСОШ №2 г. Домодедово Кузнецова Кристина, Матвеева Настя, Савина Марина 10 класс
Кузнецова Кристина, Матвеева Настя, Савина Марина 10 класс  Классификация органических веществ. Автор: Русакова А.В. учитель химии МОУ «Гимназия № 19» г. Омска.
Классификация органических веществ. Автор: Русакова А.В. учитель химии МОУ «Гимназия № 19» г. Омска. Серебро
Серебро Количественный масс-спектрометрический анализ
Количественный масс-спектрометрический анализ Классы неорганических соединений Оксиды Кислоты Соли Основания
Классы неорганических соединений Оксиды Кислоты Соли Основания Презентация на тему: Одноатомные спирты
Презентация на тему: Одноатомные спирты Гальваностегия и гальванопластика
Гальваностегия и гальванопластика