Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Содержание
- 5. Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т) + K2O(т) = = K2SO4(т) HgI2(т)
- 6. Комплексные (координационные) соединения Комплексами называют сложные частицы, образованные из реально существующих более простых, способные к самостоятельному
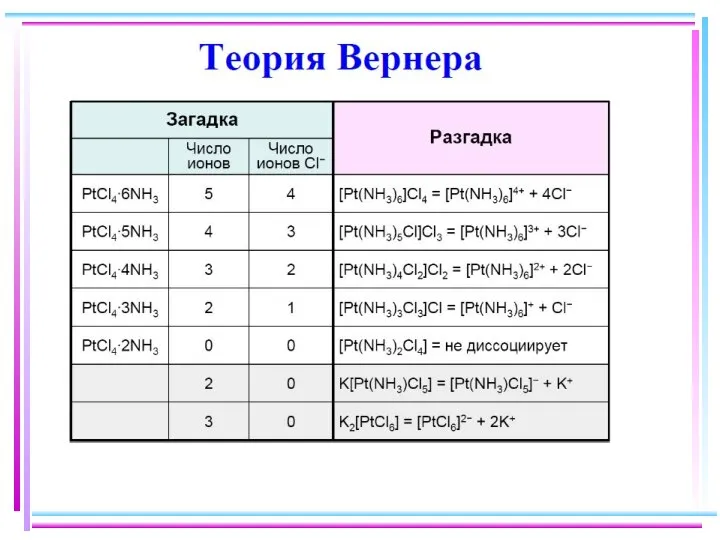
- 7. Координационная теория (1893 г. ) Внутренняя и внешняя сфера комплексного соединения [MLx]Yz Комплексообразователь M±ν Лиганды L±ν
- 8. Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет
- 9. Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4, дент.1 [Al(H2O)6]Cl3 – КЧ 6, дент.1
- 10. Полидентатные лиганды
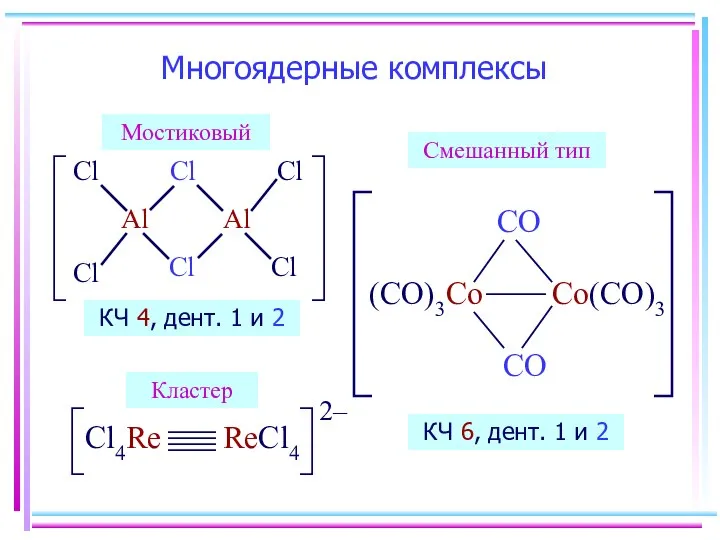
- 11. Многоядерные комплексы КЧ 4, дент. 1 и 2 Мостиковый Кластер Смешанный тип КЧ 6, дент. 1
- 12. Номенклатура комплексных соединений. 1. Названия лигандов
- 13. 2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0 Число лигандов – греч. числит. 1 – (моно) 2
- 14. 3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn] n → L → M (в
- 15. Названия комплексных соединений Б) Комплексный катион [MLn]+X– «анион катиона»: n → L → M(ст.ок.) Примеры: [AgI(NH3)2]OH
- 16. Названия комплексных соединений В) Комплексный анион X+[MLn]– «анион катиона»: анион n → L → M(ст.ок.)-«ат» Ag
- 17. Упражнения: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II) [K(H2O)6][Al(H2O)6](SO4)2 – сульфат гексаакваалюминия-гексааквакалия [(CO)5Mn-Mn(CO)5] – бис(пентакарбонилмарганец)
- 18. Изомерия комплексных соединений Изомерия – явление существования соединений, одинаковых по составу и мол. массе, но различающихся
- 19. Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+ (розов.р-р) —NCS– и —SCN– тиоцианато-N
- 20. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере. Необх. усл. геометрич.
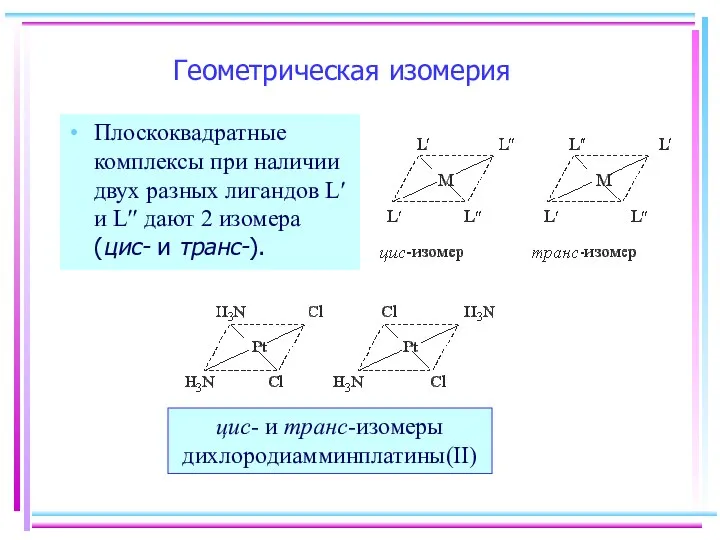
- 21. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух разных лигандов L′ и L′′ дают 2 изомера (цис-
- 22. Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)
- 23. Изомерия внутр. сферы: оптическая Оптическая (зеркальная) изомерия: способность комплексов сущ. в виде двух форм, являющихся зеркальн.
- 24. Оптическая изомерия Оптические изомеры способны вращать плоскость поляризации светового луча (влево, L-изомер, или вправо, D-изомер). Световой
- 25. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O [Co(H2O)(en)2Cl]Cl2 [Co(NH3)5I]SO4 [Co(NH3)5SO4]I 1 Cl–;
- 26. Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 pH >> 7 pH ≈
- 27. Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 ) Сильные электролиты [Pt(NH3)4]Cl2 =
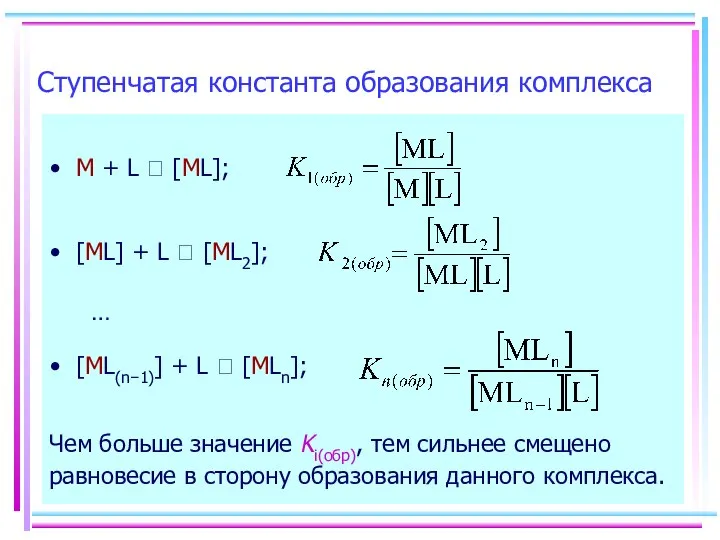
- 28. [MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ) [H2O] = Const, р-р разбавленный Ступенчатая
- 29. Чем больше значение Ki(обр), тем сильнее смещено равновесие в сторону образования данного комплекса. … Ступенчатая константа
- 30. Полные (суммарные) константы образования Характеристика устойчивости комплексного соединения: чем больше значение βn(обр), тем более устойчив комплекс
- 31. Связь между полной и ступенчатой константами образования βn(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)
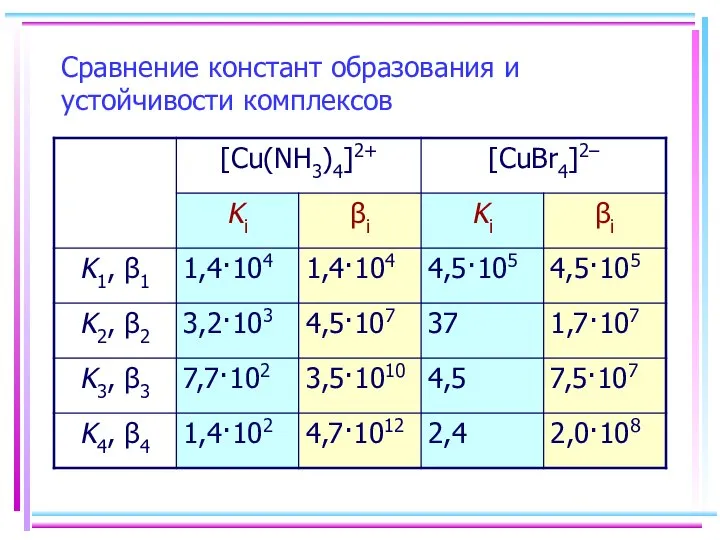
- 32. Сравнение констант образования и устойчивости комплексов
- 33. Сравнение устойчивости аммиачных комплексов Ступени комплексообразования [Cu(NH3)2]+ K2(обр) = 5,0·104 [Cu(NH3)]+ K1(обр) = 1,4·106 Природа комплексообразователя
- 34. Хелат-эффект [Ni(NH3)6]2+ β6(обр)= 5,3 . 108 [Ni(en)3]2+ β3(обр)= 1,3 . 1019 [Ni(NH3)6]2+ + 3 en +
- 35. Квантовомеханические теории строения комплексных соединений Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей
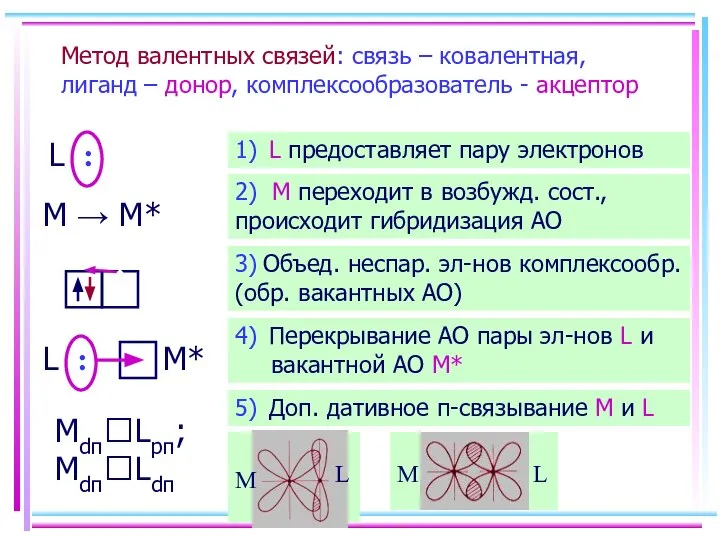
- 36. Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь - акцептор L : M →
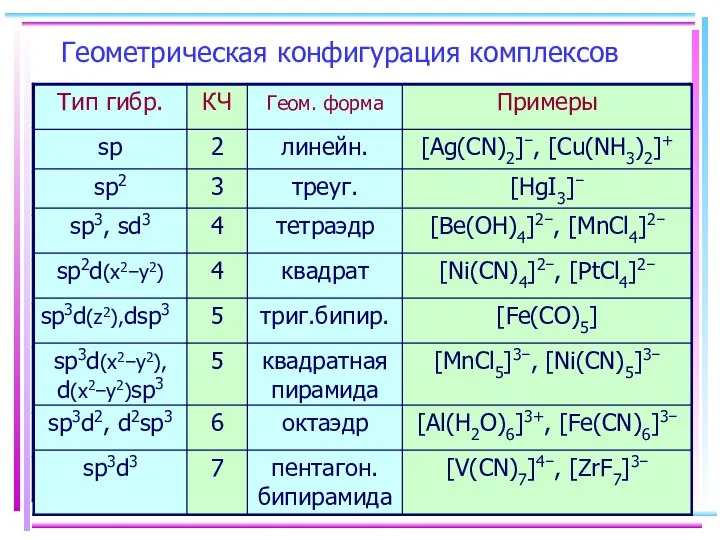
- 37. Геометрическая конфигурация комплексов
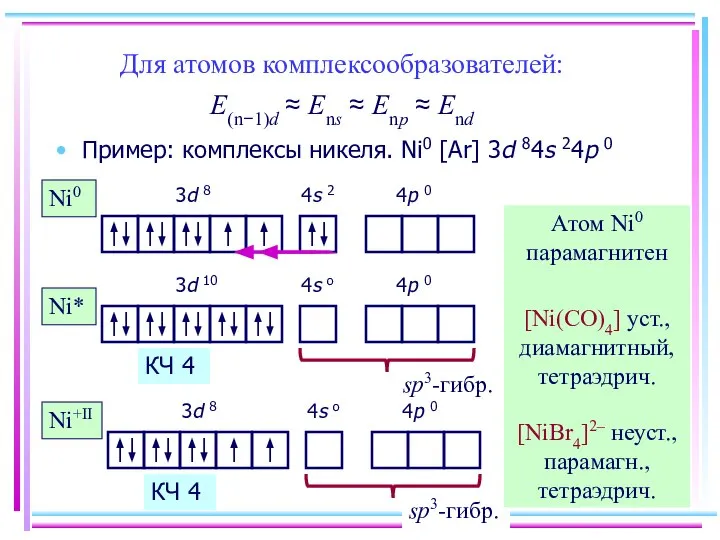
- 38. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar] 3d
- 39. Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн., квадратная пирамида КЧ 5 [Ni(H2O)6]2+, [Ni(NO2)6]4–
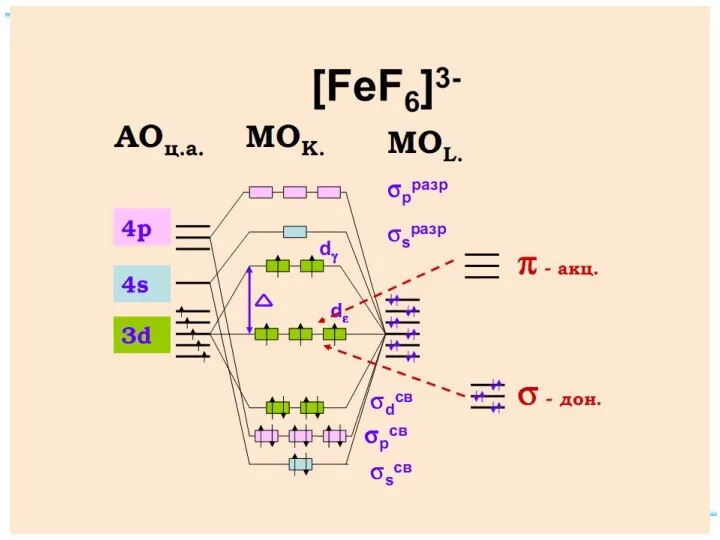
- 40. Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6
- 41. Основные положения теории кристаллического поля (поля лигандов) Связь комплексообразователя (центр. атома) Mе с лигандами L считается
- 42. В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия падает) в случае АО d(xy),
- 43. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход электронов dε ⭲ dγ невозможен Слабое поле лигандов Δmin:
- 44. Параметр расщепления Δ и волновое число ν 1 см–1 соответствует ок. 12 Дж/моль Δ : 60
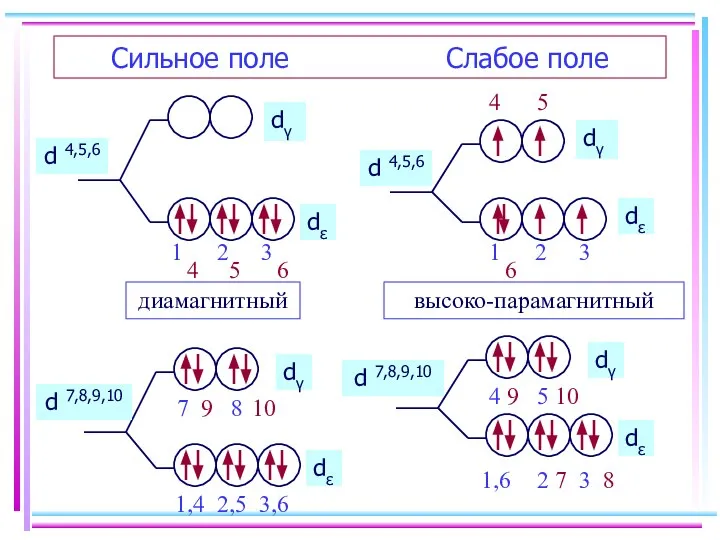
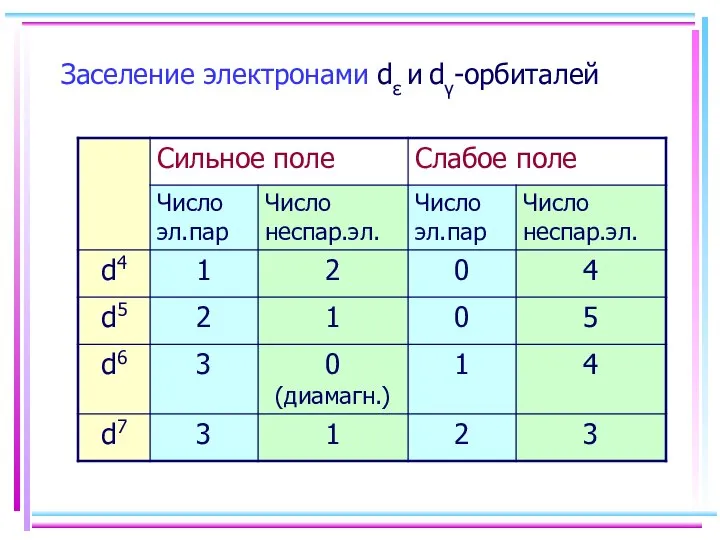
- 45. Сильное поле Слабое поле d 4,5,6 d 4,5,6 диамагнитный высоко-парамагнитный d 7,8,9,10 d 7,8,9,10
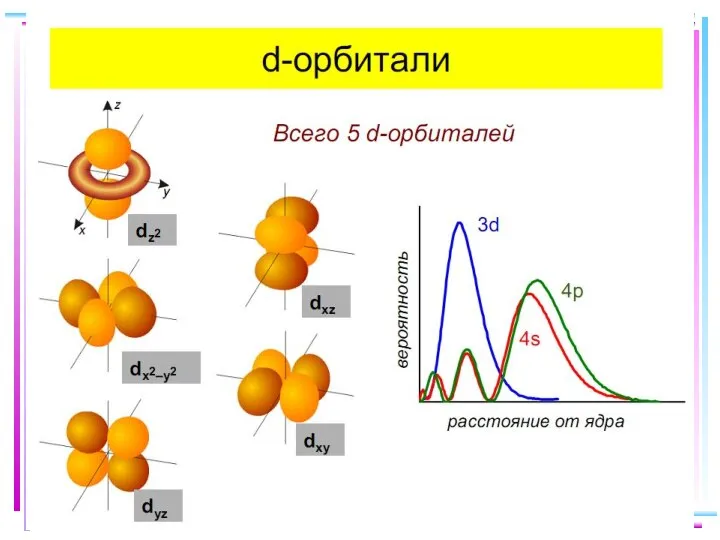
- 46. Заселение электронами dε и dγ-орбиталей
- 47. Лиганды сильного и слабого поля Спектрохимический ряд лигандов: Br – Fe+II: [Ar] 3d 64s 04p 0
- 48. Цветность комплексных соединений При облучении образца в-ва светом видимой части спектра может наблюдаться: отсутствие поглощения света
- 49. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии в видимой части спектра
- 50. Типы комплексных соединений. 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2
- 51. Аквакомплексы Термич. разложение: CuSO4·5H2O ⭣ CuSO4·4H2O + H2O(г) ⭣ CuSO4 + 4H2O(г) [Cu(H2O)4]SO4·H2O («медный купорос»)
- 52. Аквакомплексы [Fe(H2O)6]SO4·H2O («железный купорос»)
- 53. 2. Гидроксокомплексы Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) ⭣ +
- 54. 3. Аммины (аммиакаты) Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+
- 55. Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– =
- 56. 6. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″ – галогены) Получение: KI + I2 = K[I(I)2]; CsCl
- 57. Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C) 4 LiH + AlCl3
- 58. Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 °С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т)
- 59. Правило Сиджвика для определения состава комплексов Устойчивым является комплекс, в котором реализована 18-эл-ная оболочка из s-,
- 60. Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; *
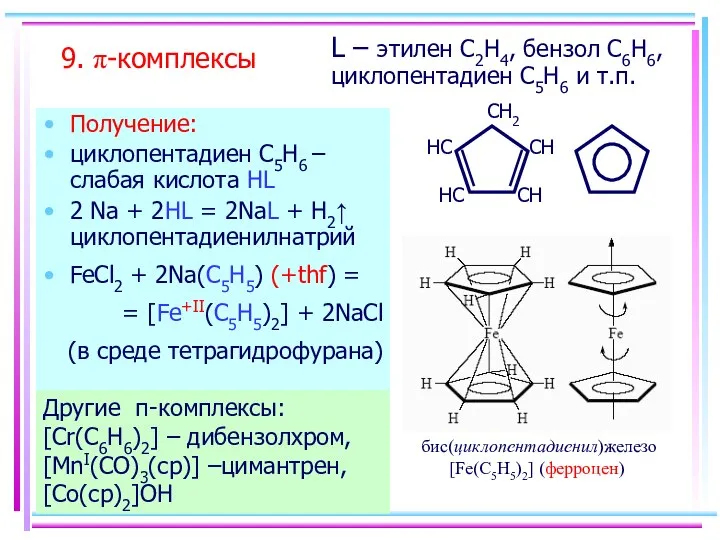
- 61. 9. π-комплексы Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL +
- 62. 10. Хелаты Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) NH2CH2COOH − α-аминоуксусная кислота (глицин)
- 63. Реакция Чугаева Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)
- 64. Методы синтеза комплексных соединений Реакция обмена лигандов А) в водном растворе (βобр, принцип Ле Шателье): [Сu(H2O)4]2+
- 65. Методы синтеза комплексных соединений Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ → [СoIIIL6]3+ Ок.:
- 66. Решение задач. 1. Растворение осадка при комплексообразовании AgBr(т) ⮀ Ag+ + Br – ; ПРAgBr =
- 67. Решение задач. 2. Реакция обмена лигандов [Co(NH3)6]3+ + 6 CN– ⮀ [Co(CN)6]3– + 6 NH3 ;
- 68. Решение задач. 3. Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+ + 4 NH4+ ; Kc
- 69. Решение задач. 4. Направление реакции CuCN(т) + H2O + HCN ⮀ [Cu(CN)2]– + H3O+ Kc =
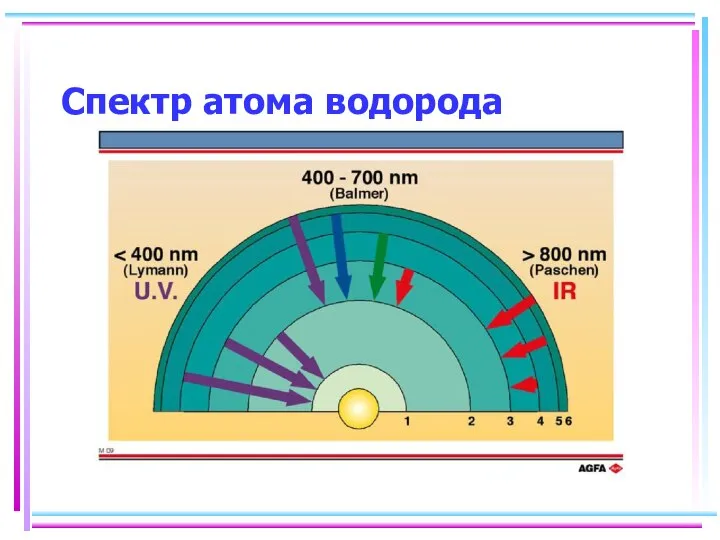
- 112. Спектр атома водорода
- 113. Спектр атома водорода
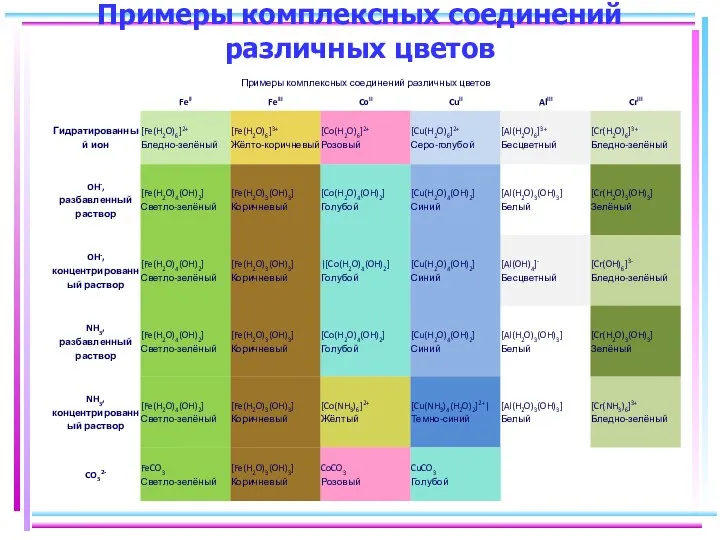
- 125. Примеры комплексных соединений различных цветов
- 128. Магнитные моменты высокоспиновых КС
- 129. Содержание Введение Комплексные ионы Комплексные соединения Реакции комплексообразования Координационные соединения Глава 1. Основные понятия координационной теории
- 130. Глава 4. Изомерия комплексных соединений 4.1. Изомерия лигандов 4.2. Геометрическая изомерия 4.3. Оптическая изомерия 4.4. Сольватная
- 132. Скачать презентацию



![Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т) +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-4.jpg)


![Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-7.jpg)
![Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4, дент.1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-8.jpg)


![2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0 Число лигандов – греч.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-12.jpg)
![3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn] n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-13.jpg)
![Названия комплексных соединений Б) Комплексный катион [MLn]+X– «анион катиона»: n →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-14.jpg)
![Названия комплексных соединений В) Комплексный анион X+[MLn]– «анион катиона»: анион n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-15.jpg)
![Упражнения: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II) [K(H2O)6][Al(H2O)6](SO4)2 –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-16.jpg)

![Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-18.jpg)

![Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-21.jpg)


![Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-24.jpg)
![Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-25.jpg)
![Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-26.jpg)
![[MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ) [H2O]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-27.jpg)


![Сравнение устойчивости аммиачных комплексов Ступени комплексообразования [Cu(NH3)2]+ K2(обр) = 5,0·104 [Cu(NH3)]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-32.jpg)
![Хелат-эффект [Ni(NH3)6]2+ β6(обр)= 5,3 . 108 [Ni(en)3]2+ β3(обр)= 1,3 . 1019](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-33.jpg)

![Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн., квадратная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-38.jpg)
![Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-39.jpg)

![В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-41.jpg)





![Типы комплексных соединений. 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-49.jpg)
![Аквакомплексы Термич. разложение: CuSO4·5H2O ⭣ CuSO4·4H2O + H2O(г) ⭣ CuSO4 + 4H2O(г) [Cu(H2O)4]SO4·H2O («медный купорос»)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-50.jpg)
![Аквакомплексы [Fe(H2O)6]SO4·H2O («железный купорос»)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-51.jpg)
![2. Гидроксокомплексы Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-52.jpg)
![3. Аммины (аммиакаты) Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-53.jpg)
![Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-54.jpg)
![6. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″ – галогены) Получение: KI](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-55.jpg)
![Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-56.jpg)
 (ниже 50 °С) тетракарбонилникель(0) Разрушение:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-57.jpg)

![Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18 –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-59.jpg)

 + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-62.jpg)



![Решение задач. 2. Реакция обмена лигандов [Co(NH3)6]3+ + 6 CN– ⮀](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-66.jpg)
![Решение задач. 3. Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1401179/slide-67.jpg)
























































 Витамины. Ашылу тарихы
Витамины. Ашылу тарихы ЖИДКИЕ КРИСТАЛЛЫ И ПРИБОРЫ НА ИХ ОСНОВЕ В настоящее время технологии жидкокристаллических мониторов ЖК были известны химик
ЖИДКИЕ КРИСТАЛЛЫ И ПРИБОРЫ НА ИХ ОСНОВЕ В настоящее время технологии жидкокристаллических мониторов ЖК были известны химик Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева Алкины. Химические и физические свойства алкинов
Алкины. Химические и физические свойства алкинов Aqueous Solutions of Electrolytes
Aqueous Solutions of Electrolytes Презентация по Химии "Атоми,молекули, йони, хімічні елементи, їхні назви й символи" - скачать смотреть бесплатно
Презентация по Химии "Атоми,молекули, йони, хімічні елементи, їхні назви й символи" - скачать смотреть бесплатно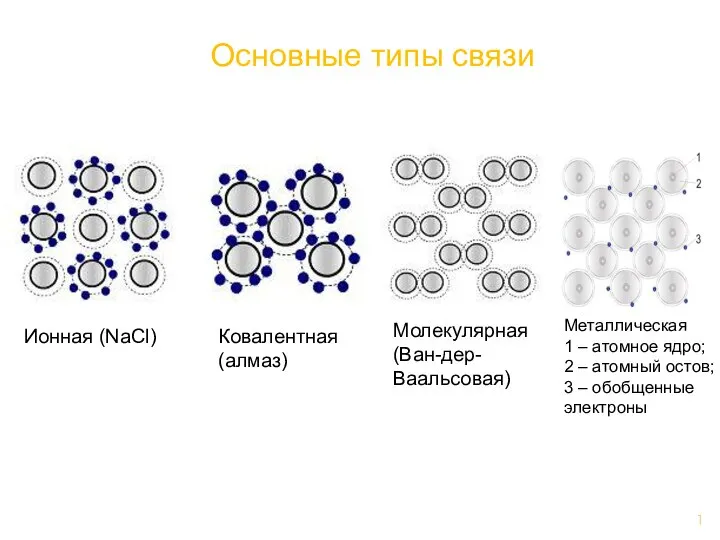 Основные типы связи
Основные типы связи Дослідження розчинності речовин природознавство
Дослідження розчинності речовин природознавство Циклоалканы. Номенклатура
Циклоалканы. Номенклатура Жири як компоненти їжі. Їхня роль в організмі
Жири як компоненти їжі. Їхня роль в організмі  Жыныс гормондарының түзілуі және маңызы
Жыныс гормондарының түзілуі және маңызы Сероводород
Сероводород Bool-doser team
Bool-doser team Самозаймання речовин та матеріалів. Особливості самозаймання. Види самозаймання
Самозаймання речовин та матеріалів. Особливості самозаймання. Види самозаймання Катодные процессы при коррозии металла
Катодные процессы при коррозии металла Скорость химической реакции
Скорость химической реакции Растворы и их классификация
Растворы и их классификация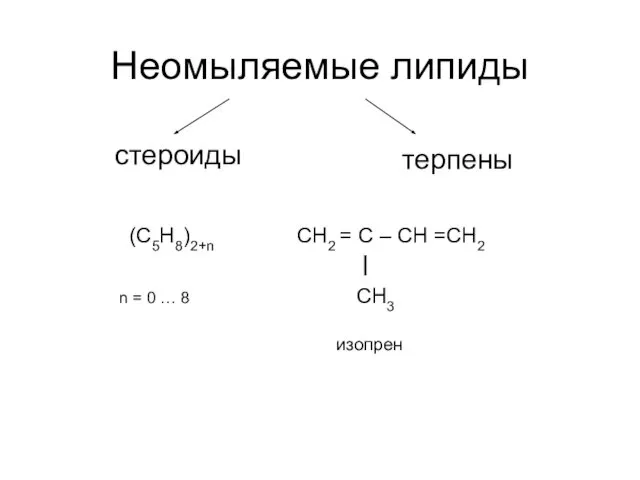 Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Ископаемое топливо
Ископаемое топливо Давайте повторим Заключительный урок в 8 классе
Давайте повторим Заключительный урок в 8 классе  Комбинированные задачи. Задание 34
Комбинированные задачи. Задание 34 Опасность озоновых дыр
Опасность озоновых дыр Соли
Соли Углеводы. Карбоновые кислоты и их производные
Углеводы. Карбоновые кислоты и их производные Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Молярный объём газообразного вещества
Молярный объём газообразного вещества Тепловой эффект химических реакций
Тепловой эффект химических реакций Структурно-механiчнi (реологiчнi) властивостi харчових мас
Структурно-механiчнi (реологiчнi) властивостi харчових мас