Содержание
- 2. План 1. Закон действующих масс. Константа равновесия 2. Типы констант равновесия. Кислотно-основные реакции. Реакции комплексообразования. Реакции
- 3. Закон действующих масс (ЗДМ): «Скорость химической реакции при постоянной температуре прямопропорциональна произведению концентраций реагирующих веществ в
- 4. Для равновесной химической реакции: aA + bB ⮀ cC + dD Скорость прямой реакции: V1 =
- 6. где - активности исходных веществ А и В и продуктов реакции С и D.
- 7. Теория сильных электролитов Активность (а) - это мера реального поведения вещества в растворе. Ее значение связано
- 8. Протолитическая теория кислот и оснований НА ⮀ Н+ + А- а1 b1 В + Н+ ⮀
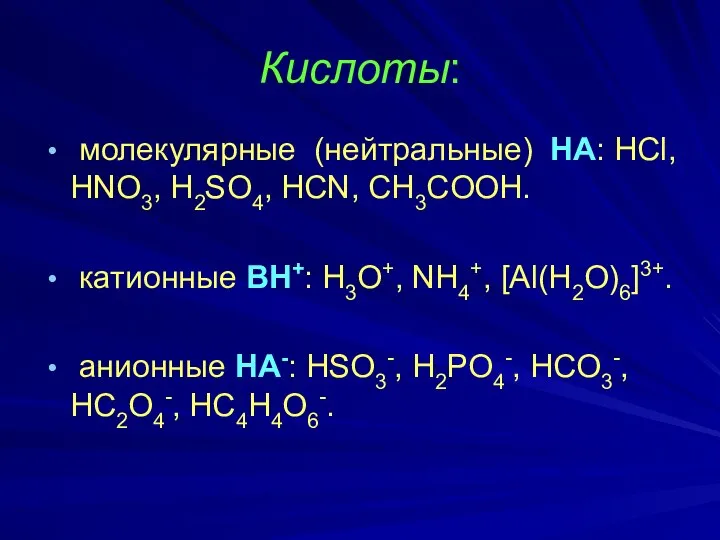
- 9. Кислоты: молекулярные (нейтральные) НА: HCl, HNO3, H2SO4, HCN, CH3COOH. катионные ВН+: H3O+, NH4+, [Al(H2O)6]3+. анионные НА-:
- 10. Основания: молекулярные (нейтральные) В: NH3, CH3-NH2, C6H5N, NaOH, H2N-NH2. катионные В+: H2N-NH3+, [Zn(OH)(H2O)3]+. анионные А-: Сl-,
- 11. Амфолиты: анионные кислоты, они же анионные основания НА-: HSO3-, H2PO4-, HCO3-. нейтральные молекулы В: [Zn(OH)2(H2O)2]. катионные
- 12. Протолитические равновесия в воде H2О ⮀ H+ + OH- В разбавленных растворах концентрация воды как растворителя
- 13. Протолитические равновесия в воде КС∙[Н2О] = КН2О = Кw = 1,86∙10-16 ∙55,56 =10-14 Kw = [H+]
- 14. Протолитические равновесия в воде рКw = - lg Kw = -lg 10-14 = 14 рKw =
- 15. HA + H2О ⮀ H3O+ + A-
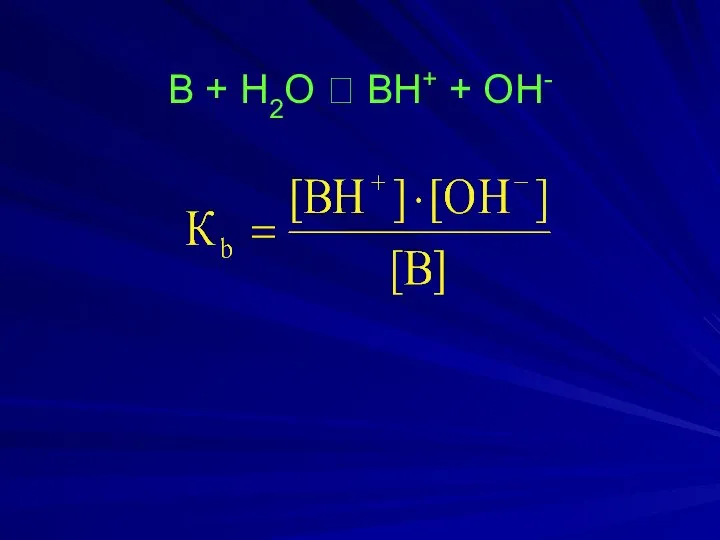
- 16. B + H2O ⮀ BH+ + OH-
- 17. закон разбавления (закон разведения) Оствальда: При α
- 18. Расчет рН Для сильных кислот: HCl, HBr, HI, HNO3, H2SO4, HClO4. pH = -lg[H+] Для сильных
- 19. Расчет рН Для слабых кислот: рН = ½ рKа – ½ lgСа Для слабых оснований: pН
- 20. Константа образования или устойчивости β: M + L ↔ [ML] [ML] + L ↔ [ML2] M
- 21. Ag+ + NH3 ⮀ [AgNH3]+ [AgNH3]+ + NH3 ⮀ [Ag(NH3)2]+
- 22. Константа нестойкости Кнест. [Ag(NH3)2]+ ⮀ Ag+ + 2 NH3
- 23. Для электролита КnАm ↔ nКm+ + mАn-
- 24. Концентрационное произведение растворимости: ПРс = [Кm +]n ∙ [А n-]m
- 25. Для BaSO4 – электролита однотипного состава (бинарного электролита)
- 26. Для Cа3(РО4)2 – электролита неоднотипного состава
- 27. Для бинарных электролитов: Для любых осадков: ПР = mm ∙ nn ∙ Pm+n
- 29. Реакции окисления-восстановления Ox + nē ⮀ Red Оx + nē + mH+ ⮀ Red
- 30. Реакции окисления-восстановления ΔE = E01 - E0 2
- 31. Реакции окисления-восстановления Fe3+ + ē ⮀ Fe2+ 2I- - 2ē ⮀ I2 ΔE = 0,771 –
- 33. Скачать презентацию










![Протолитические равновесия в воде КС∙[Н2О] = КН2О = Кw = 1,86∙10-16](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404254/slide-12.jpg)





![Константа образования или устойчивости β: M + L ↔ [ML] [ML]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404254/slide-19.jpg)
![Ag+ + NH3 ⮀ [AgNH3]+ [AgNH3]+ + NH3 ⮀ [Ag(NH3)2]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404254/slide-20.jpg)
![Константа нестойкости Кнест. [Ag(NH3)2]+ ⮀ Ag+ + 2 NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404254/slide-21.jpg)

![Концентрационное произведение растворимости: ПРс = [Кm +]n ∙ [А n-]m](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404254/slide-23.jpg)







 Гліцерин (Гліцерол)
Гліцерин (Гліцерол) ВМС и растворы ВМС
ВМС и растворы ВМС Непредельные углеводороды алкены
Непредельные углеводороды алкены Презентация по Химии "углерод" - скачать смотреть бесплатно
Презентация по Химии "углерод" - скачать смотреть бесплатно Металлы в нашей жизни
Металлы в нашей жизни Углеводы
Углеводы Катализаторы. Ферменты
Катализаторы. Ферменты Презентация Карбонаты
Презентация Карбонаты  Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ Использование энергии солнца на земле
Использование энергии солнца на земле Дикарбоновые кислоты
Дикарбоновые кислоты Адиабатическое приближение
Адиабатическое приближение Минерал клинохлор. Месторождения
Минерал клинохлор. Месторождения Презентация по Химии "Таблица Периодическая система химических элементов Д.И. Менделеева" - скачать смотреть
Презентация по Химии "Таблица Периодическая система химических элементов Д.И. Менделеева" - скачать смотреть  Презентация Производство стекла
Презентация Производство стекла История получения алюминия и его применение
История получения алюминия и его применение Сarbonyl compounds. Carboxylic acids. Lipids
Сarbonyl compounds. Carboxylic acids. Lipids Классификация минералов + самородные элементы. Занятие 5
Классификация минералов + самородные элементы. Занятие 5 Сера. Строение и свойства атома серы
Сера. Строение и свойства атома серы ПРИРОДНИЙ ГАЗ
ПРИРОДНИЙ ГАЗ  Презентация по Химии "Тема: Цікаві факти з життя Д.І. Менделєєва" - скачать смотреть бесплатно
Презентация по Химии "Тема: Цікаві факти з життя Д.І. Менделєєва" - скачать смотреть бесплатно Химия и здоровье
Химия и здоровье Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть
Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть  Вольфрам және молибден
Вольфрам және молибден Лекарственные препараты
Лекарственные препараты  Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии
Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии Екстракція і йонний обмін
Екстракція і йонний обмін