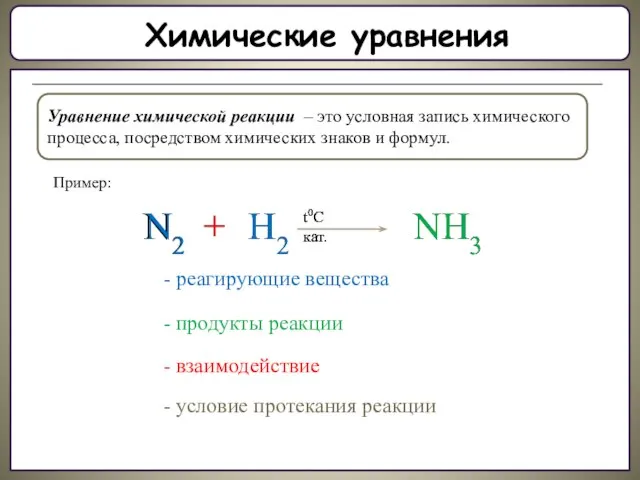
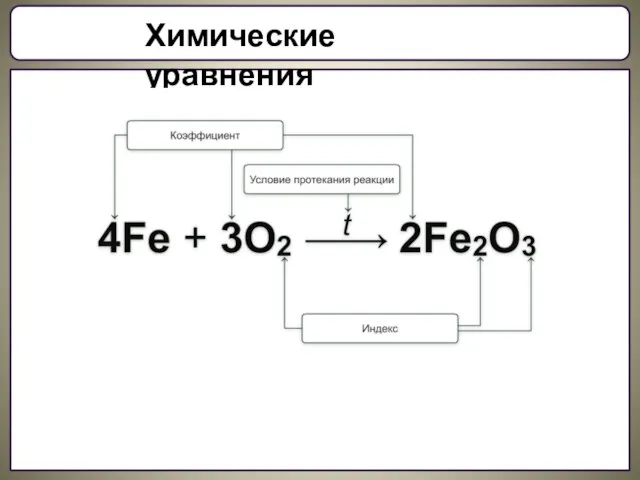
Составление химических реакций
Пример: Составить уравнение реакции взаимодействия фосфора и кислорода.
1. В
левой части уравнения запиши формулы веществ, которые вступают в реакцию. (Формулы простых газообразных веществ состоят из двух атомов: Н2, О2, N2, Cl2 и.т.д.)
2. В правой части уравнения запиши формулы веществ образующихся в результате реакции.
P2O5
3. Определи: атомов, какого элемента в левой части уравнения больше. (Вначале уравнивают число атомов, которых в левой части уравнения больше.)
4. Соедини фигурной стрелкой атомы этого элемента в левой и правой частях.
5. Определи Н.О.К. чисел атомов в левой и правой частях уравнения.
10
6. Запиши Н.О.К. в квадратике под стрелкой.
7. Раздели Н.О.К. на число атомов каждого соединенного элемента.
8. Запиши полученный коэффициент перед формулой.
5
2
9. Определи: есть ли еще не уравненные (не соединенные) атомы:
а) Если есть, то вернись к пункту 3.
б) Если нет, то ВСЁ.
4
4






 Сульфаты. Лекция 13
Сульфаты. Лекция 13 Основные понятия химии
Основные понятия химии Фосфорная кислота
Фосфорная кислота Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Обобщение и подготовка к химии 8 класс
Обобщение и подготовка к химии 8 класс Аттестационная работа. Методическая разработка индивидуальной исследовательской работы по химии педагогического колледжа
Аттестационная работа. Методическая разработка индивидуальной исследовательской работы по химии педагогического колледжа Квантовая механика- теоретическая основа современной химии
Квантовая механика- теоретическая основа современной химии Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Коррозия металлов
Коррозия металлов Цікаві факти про воду
Цікаві факти про воду  Аминокислоты Модели молекул
Аминокислоты Модели молекул  Основные понятия и законы химии
Основные понятия и законы химии Неньютоновская жидкость
Неньютоновская жидкость Неделя химии в МБОУ Андреевская ООШ
Неделя химии в МБОУ Андреевская ООШ Геохимия природных процессов
Геохимия природных процессов Алкины
Алкины Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Кристаллография. История развития
Кристаллография. История развития Гетерофункциональные соединения. (Лекция 14)
Гетерофункциональные соединения. (Лекция 14) Презентация по Химии "Соединения серы (11 класс)" - скачать смотреть
Презентация по Химии "Соединения серы (11 класс)" - скачать смотреть  Презентация по Химии "РАСТВОРЕНИЕ. РАСТВОРЫ" - скачать смотреть бесплатно
Презентация по Химии "РАСТВОРЕНИЕ. РАСТВОРЫ" - скачать смотреть бесплатно Атомы, молекулы, химические элементы. Формы существования элементов в природе
Атомы, молекулы, химические элементы. Формы существования элементов в природе Углерод, физические и химические свойства
Углерод, физические и химические свойства Презентация Электролиз
Презентация Электролиз Дюралюминий. Дюраль
Дюралюминий. Дюраль Нефть Состав, свойства, переработка
Нефть Состав, свойства, переработка  Явления физические и химические. Признаки и условия протекания химических реакций
Явления физические и химические. Признаки и условия протекания химических реакций