Содержание
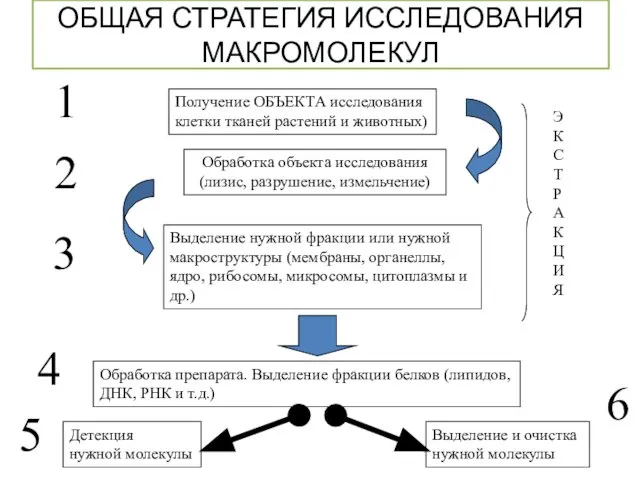
- 2. ОБЩАЯ СТРАТЕГИЯ ИССЛЕДОВАНИЯ МАКРОМОЛЕКУЛ Получение ОБЪЕКТА исследования клетки тканей растений и животных) Обработка объекта исследования (лизис,
- 3. Геномный анализ Геномный анализ — это один из цитогенетических методов исследования, изучающий число геномов в данном
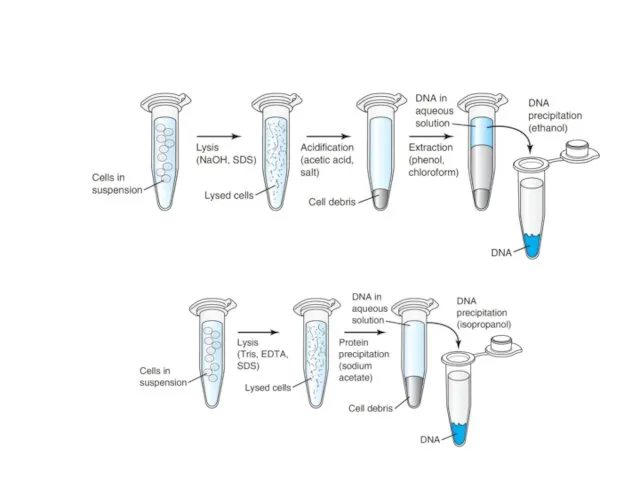
- 4. Методы выделения и очистки геномной ДНК
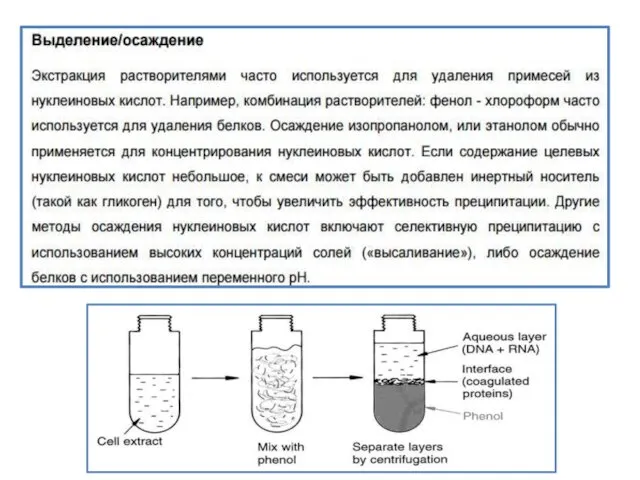
- 5. Выделение и очистка ДНК Основная цель этапов выделения ДНК - последовательная очистка ДНК от контаминирующего материала
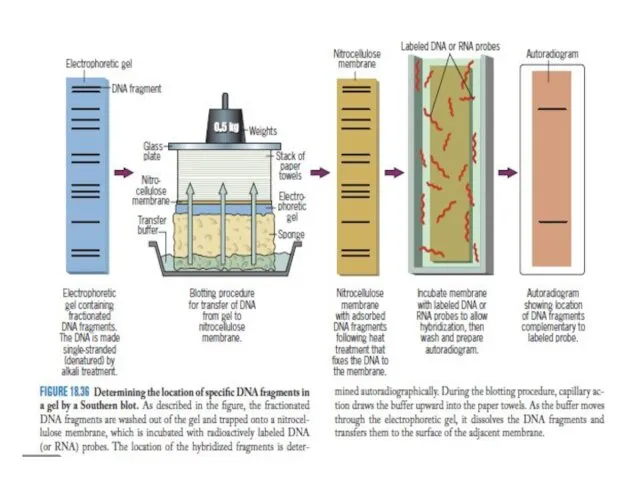
- 15. Существует несколько методов ДНК–тестирования (анализа) Электрофорез ДНК в агарозном геле, в полиакриламидном геле Анализ полиморфизма длины
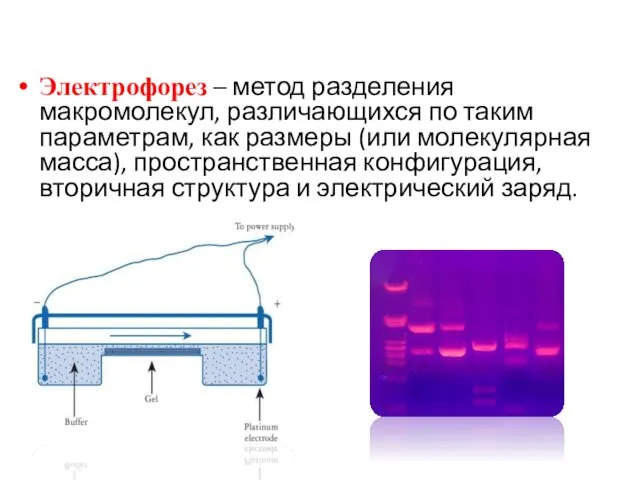
- 16. Электрофорез – метод разделения макромолекул, различающихся по таким параметрам, как размеры (или молекулярная масса), пространственная конфигурация,
- 17. Фракционирование НК. Гель-электрофорез ДНК
- 18. Преимущества агарозного геля прочность агарозного геля; крупнопористость (позволяющая разделять особенно крупные молекулы, в частности нуклеиновые кислоты);
- 19. Агароза очень хрупка, легко разрушается при манипулировании. Агарозные гели имеют «поры» большого размера и используются преимущественно
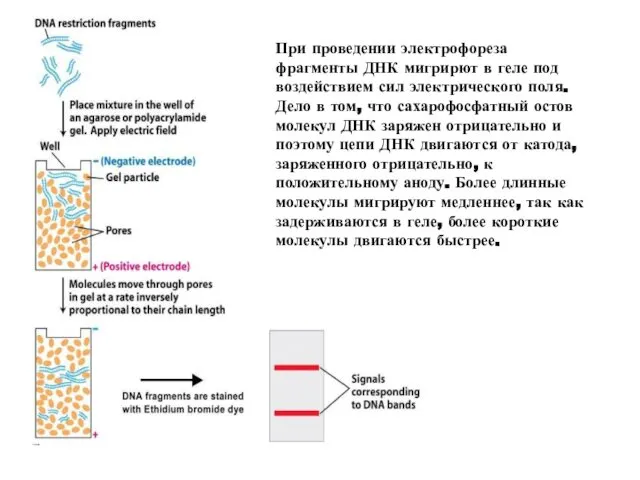
- 20. При проведении электрофореза фрагменты ДНК мигрирют в геле под воздействием сил электрического поля. Дело в том,
- 21. Разделение фрагментов ДНК происходит из-за наличия у них заряда. Фосфатные остатки у нуклеотидов придают всей ДНК
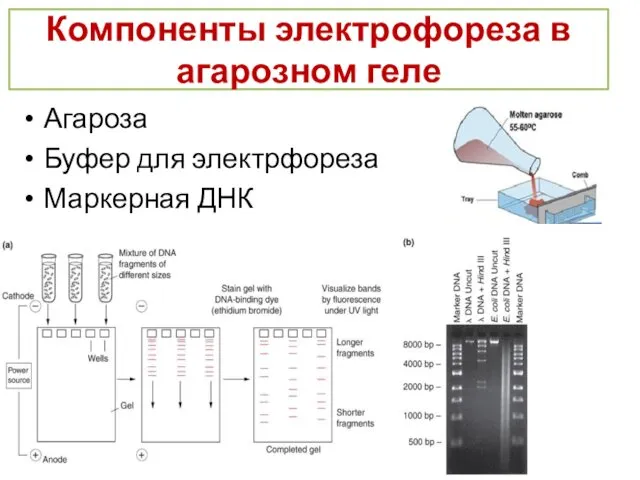
- 22. Компоненты электрофореза в агарозном геле Агароза Буфер для электрфореза Маркерная ДНК
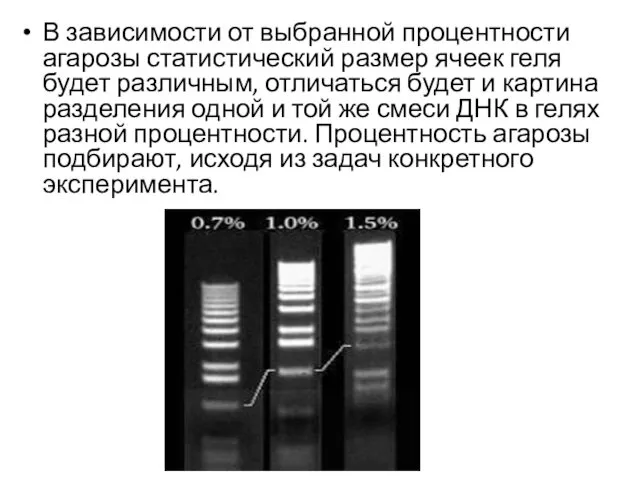
- 23. В зависимости от выбранной процентности агарозы статистический размер ячеек геля будет различным, отличаться будет и картина
- 24. Буфер для электрофореза Электрофорез проводится в камере, заполненной буферным раствором. Чаще всего используются буферы, содержащие ЭДТА,
- 25. Перед началом электрофореза к образцам добавляют два разных красителя с кислым значением pН (часто для этих
- 26. В образец добавляется глицерин(Loading buffer) + краситель(loading dye) концентрация молекул ДНК в образце желательно > 50
- 27. EtBr (бромистый этидий) является наиболее распространенным реагентом, который используется для окрашивания ДНК в агарозном геле. Под
- 28. Картирование и секвенирование - наиболее важные и трудоемкие части всех геномных исследований Картирование - определение положения
- 29. Карты генетического сцепления строят, наблюдая за тем, как часто два маркера наследуются вместе. Два маркера, расположенные
- 30. Хромосомные карты показывают расположение генов или отдельных участков ДНК на соответствующих хромосомах, а расстояние между генами
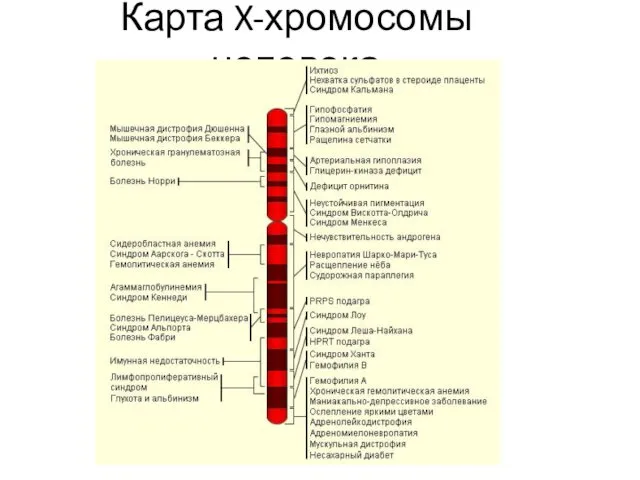
- 31. Карта X-хромосомы человека
- 32. Графическое представление нормального человеческого кариотипа в виде идеограмм всех его хромосом
- 33. Последняя стадия физического картирования генома человека - определение всех пар оснований на каждой хромосоме, то есть
- 34. Методы секвенирования, то есть прочтения последовательности нуклеотидов в молекуле ДНК, дают наиболее полную информацию о геноме.
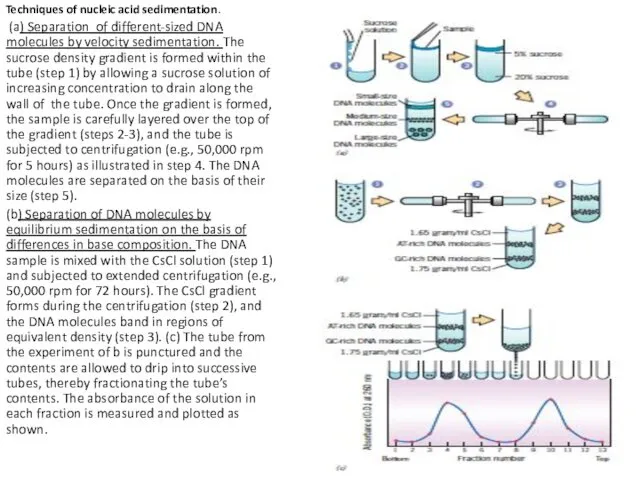
- 35. Techniques of nucleic acid sedimentation. (a) Separation of different-sized DNA molecules by velocity sedimentation. The sucrose
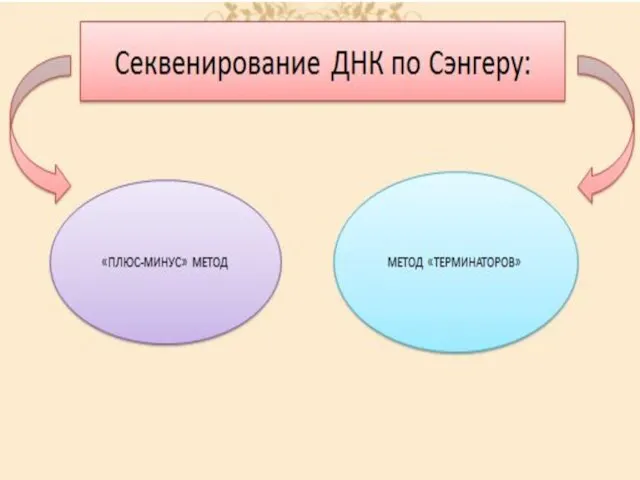
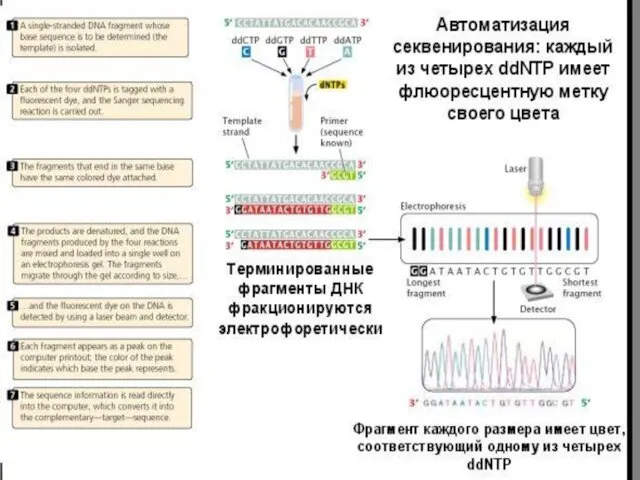
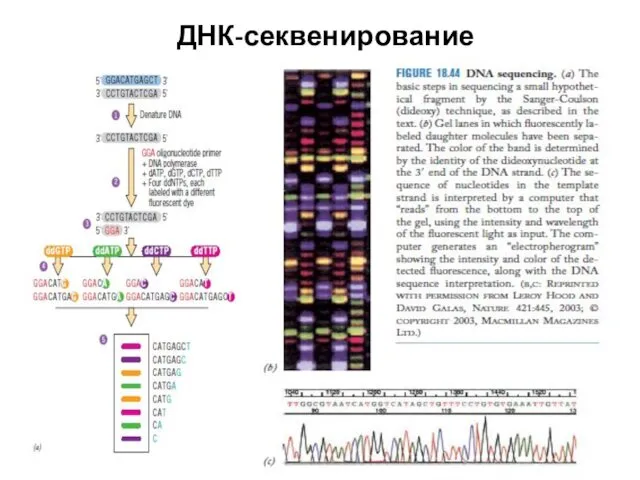
- 37. Метод Сэнгера (плюс-минус метод) — метод секвенирования(определения последовательности нуклеотидов) ДНК, также известен как метод обрыва цепи
- 38. Метод включал два этапа. Сначала в ограниченных условиях проводили полимеразную реакцию в присутствии всех 4-х типов
- 39. Секвенирование ДНК по Максаму-Гилберту (метод терминаторов) - Этот метод также называется секвенированием ДНК методом химической деградации
- 42. ДНК-секвенирование
- 43. Геномные анализы помогают выявить Хромосомные болезни — наследственные заболевания, обусловленные изменением числа или структуры хромосом. К
- 44. Болезни, обусловленные нарушением числа хромосом синдром Дауна — трисомия по 21-й хромосоме, синдром Патау — трисомия
- 45. Благодаря геномным исследованиям, а также совершенствованию инструментальной диагностической медицинской техники появилась возможность обнаружения "патологического" гена в
- 46. Геномные исследования и идентификация генов, повреждение которых приводит к заболеваниям, позволяет глубже понять биохимические процессы, определяющие
- 47. Результаты геномных исследований все шире используются в судебной медицине. Появление технологии геномной диагностики (DNA fingerprinting) позволило
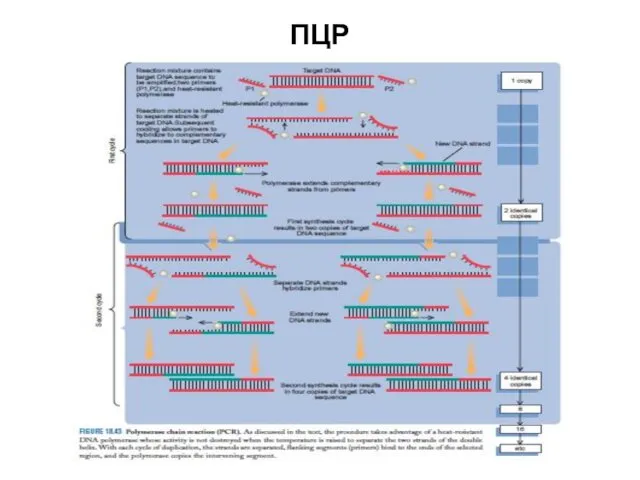
- 49. ПЦР
- 51. Скачать презентацию

































 Kazeoz sətəlcəm
Kazeoz sətəlcəm Неспецифические воспалительные заболевания женских половых органов
Неспецифические воспалительные заболевания женских половых органов Малобюджетные решения и профилактика против вросших волос
Малобюджетные решения и профилактика против вросших волос Врожденные аномалии
Врожденные аномалии Заболевания перикарда
Заболевания перикарда Вирусные гепатиты
Вирусные гепатиты Догляд за хворими з хірургічними захворюваннями і ушкодженнями кінцівок
Догляд за хворими з хірургічними захворюваннями і ушкодженнями кінцівок Хронічний панкреатит. Псевдокісти підшлункової залози
Хронічний панкреатит. Псевдокісти підшлункової залози Гигиена органов дыхания
Гигиена органов дыхания Гостре інфекційне захворювання кашлюк
Гостре інфекційне захворювання кашлюк Исследование раненых животных. Диагностика и лечение свежих ран
Исследование раненых животных. Диагностика и лечение свежих ран Ет ткані. Қаңқа ет тканінің регенерациясы. Өмір сүру салтына және жасқа байланысты
Ет ткані. Қаңқа ет тканінің регенерациясы. Өмір сүру салтына және жасқа байланысты Ранние половые связи
Ранние половые связи Инфекционные осложнения боевых повреждений
Инфекционные осложнения боевых повреждений Визуальная диагностика поджелудочной железы
Визуальная диагностика поджелудочной железы Медико-биологические значения соединений селена и теллура
Медико-биологические значения соединений селена и теллура Тромбоз мезентериальных сосудов
Тромбоз мезентериальных сосудов Фебрильная шизофрения за 10 минут
Фебрильная шизофрения за 10 минут Основы учения об инфекции
Основы учения об инфекции Комы при сахарном диабете
Комы при сахарном диабете Острый коронарный синдром
Острый коронарный синдром Мариинская городская больница
Мариинская городская больница Лазерное вагинальное омоложение
Лазерное вагинальное омоложение Физиологические механизмы и закономерности развития физических качеств и двигательных навыков
Физиологические механизмы и закономерности развития физических качеств и двигательных навыков Профилактика снижения зрения
Профилактика снижения зрения Пневмонии у детей
Пневмонии у детей Иерсиниялар
Иерсиниялар Структуры детских лечебно-профилактических учреждений в России
Структуры детских лечебно-профилактических учреждений в России