Содержание
- 2. Парапротеинемические гемобластозы- - опухолевые заболевание кроветворной ткани, представленные В-лимфоцитами и плазматическими клетками, которые синтезируют в избыточном
- 3. Классификация Множественная миелома Макроглобулинемия Вальденстрема Болезнь тяжелых цепей
- 4. Множественная миелома
- 5. Множественная миелома Множественная миелома – плазмо-клеточная опухоль, характеризующаяся деструктивным поражением скелета, развитием почечной недостаточности, анемии и
- 6. История вопроса 1845г. -первые описания (МсIntyre и Watson) 1848г.- Bence-Jones описал некую «живую материю» белкового происхождения,
- 8. Эпидемиология - ММ составляет 1% всех онкологических заболеваний и не многим более 10% всех гемобластозов. Частота
- 9. Этиология Этиологическая роль вирусов и ионизирующего излучения не доказана -Профессиональные вредности: пестициды, инсектициды, продукты нефти, тяжелые
- 10. Объектом опухолевой трансформации является клетка-предшественница В-лимфоцитов, прошедшая этапы актигензависимой дифференцировки, способная дифференцироваться до плазмоцита, секретирующего PIg;
- 11. Хромосомные поломки при ММ Почти все пациенты с ММ имеют хромосомные аномалии Нарушения кариотипа: 8-30% пациентов
- 12. Патогенез миеломы Стромальная клетка к/м Моноклональная гаммапатия неустан.генеза Интрамедул. очаги Экстрамедул. очаги ММ
- 13. Миеломные клетки
- 14. Основные жалобы Костные боли: 58% Слабость: 32% Потеря веса: 24% Парестезии: 5% Около 20% пациентов не
- 15. Клинические проявления миеломы
- 18. Показания к обследованию при подозрении на ММ Возраст старше 40 лет и любое из следующего: Необъяснимая
- 19. формирование монетных столбиков из эритроцитов Слабость, усталость, летаргия Рецидивирующие инфекции Ускорение СОЭ Необъяснимая периферическая нейропатия Гиперкальциемия
- 20. Основные симптомы при диагностике ММ Моноклональный белок: 93% Костные деструкции: 67% Плазмацитоз в костном мозге: 96%
- 22. Критерии диагноза. Гемограмма- анемия, ускоренная СОЭ, плазматические клетки (более 5%); Миелограмма- увеличение плазматических клеток (более 10%);
- 23. Лабораторная диагностика. Общий анализ крови с подсчетом тромбоцитов, ретикулоцитов; ОАМ; Определение общего белка сыворотки крови; Электрофорез
- 24. Лабораторная диагностика (продолжение). БАК- креатинин, мочевина, мочевая кислота, кальций, ЛДГ, щелочная фосфатаза, Bi, трансаминазы, СРБ; Рентгенография
- 26. РР М-градиент
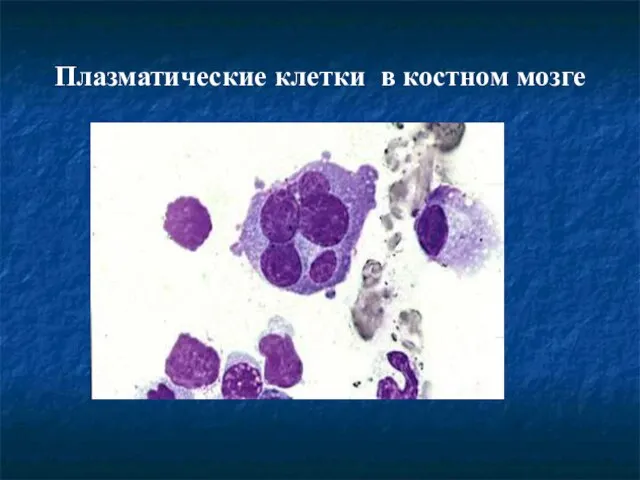
- 27. Плазматические клетки в костном мозге
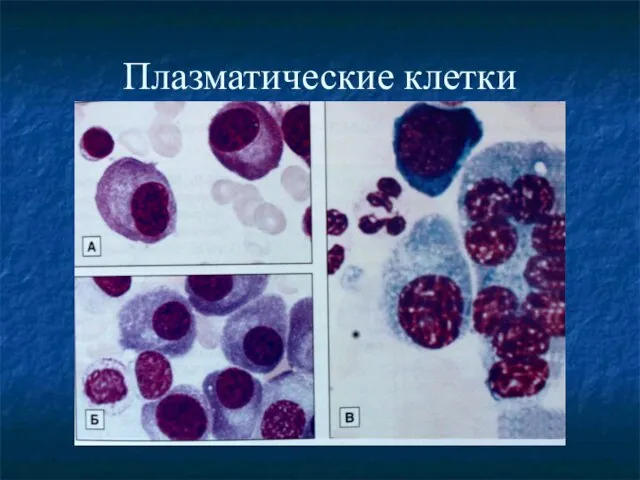
- 28. Плазматические клетки
- 29. Гистологический препарат костного мозга при миеломной болезни
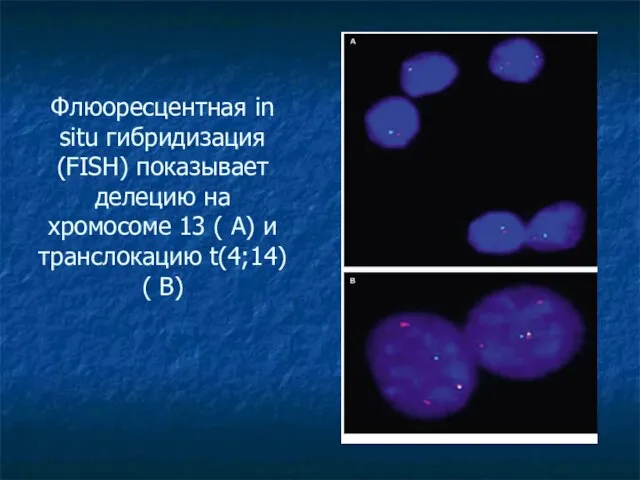
- 30. Флюоресцентная in situ гибридизация (FISH) показывает делецию на хромосоме 13 ( А) и транслокацию t(4;14) (
- 31. Косвенные признаки ММ. Ro-логический метод выявления остеодеструкций, но специфических изменений скелета не существует. Отсутствие остеодеструкций не
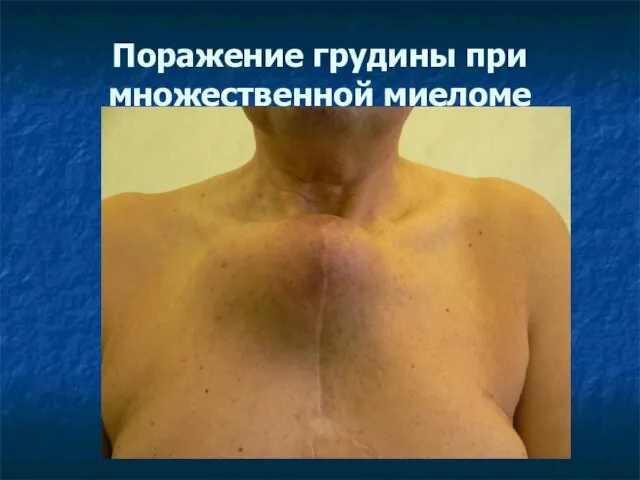
- 38. Поражение грудины при множественной миеломе
- 39. ПЭТ. Исследование всего тела.
- 40. Показания к лечению Критерием к началу проведения системной терапии у пациентов с множественной миеломой является признаки
- 41. Принципы и цели терапии Принципы лечения -Подавление роста опухоли -Улучшение качества жизни -Увеличение общей выживаемости Цели
- 42. Лечение ММ Химиотерапия: используются протоколы: МР, СР, МСР, СVD, VAD; Сопроводительная терапия. Трансплантация костного мозга,
- 43. Иммуномодулирующая терапия ( талидомид, леналидомид). Механизмы действия подавление адгезии, продукции цитокинов, ангиогенеза увеличение пролиферации Т-клеток, клеточную
- 44. Критерии отбора пациентов на трансплантацию Возраст: менее 70 лет для аутологичной трансплантации Соматический статус: статус по
- 45. Трансплантация возможна? да нет Dex/ VAD Thal/Dex Rev/Dex Velcade/ Dex PAD (Velcade*Doxil*Dex) VTD, VRD возраст Сопутствующие
- 46. Лимфогранулематоз гемобластоз с первичным поражением лимфоидной ткани, в основе которого лежит опухолевая пролиферация лимфоидных клеток с
- 47. Эпидемиология Заболеваемость в России - 2,3 на 100000 населения. Болеют лимфомой Ходжкина люди любого возраста. Мужчины
- 48. Этиология Причины возникновения болезни в настоящий момент окончательно не установлены. Описаны редкие случаи заболевания лимфомой в
- 49. Морфология опухолевых клеток при ЛХ Опухолевым субстратом ЛХ являются клетки Березовского-Штернберга и их варианты, расположенные среди
- 50. Патогенез Клетки Березовского-Штернберга и клетки Ходжкина происходят из генетически измененных В-лимфоцитов зародышевого центра, утративших способность к
- 51. Классификация. Лимфоцитарный с преобладанием лимфоидной ткани. Нодулярный (узловатый) склероз; Смешанно-клеточный; С подавлением лимфоидной ткани (лимфоцитарное истощение).
- 52. Стадии болезни. I стадия- поражение одной или двух смежных групп лимфоузлов, расположенных по одну сторону диафрагмы,
- 53. Стадии (продолжение) III стадия- поражение лимфоузлов любых областей по обе стороны диафрагмы, сопровождаемое локализованным поражением одного
- 54. Клиническая картина. Триада симптомов-профузные ночные поты, лихорадка, генерализованный кожный зуд. Похудание на 10% и более за
- 55. Клиническая классификация (по стадиям) Стадия I - поражение одной лимфатической зоны или одного лимфоидного органа (селезенка,
- 56. Стадия III - поражение лимфатических зон с обеих сторон диафрагмы (III), которое может сопровождаться поражением селезенки
- 57. Прогностические факторы. Неблагоприятные: Наличие крупных более 5 см. лимфоузлов, образующих конгломераты; Массивное поражение селезенки; Ускоренная СОЭ-
- 58. Лабораторная диагностика: Гемограмма- нейтрофильный лейкоцитоз со сдвигом влево; Лимфоцитопения; Ускоренная СОЭ; Миелограмма или трепанат костного мозга-
- 59. Диагностика Биопсия лимфатического узла Рентгенограмма легких в 2 проекциях Компьютерная томография органов шеи, ОГК, ОБП, ОМТ
- 60. Лечение Лимфома Ходжкина – одна из немногих болезней, смертность от которой была существенно снижена в последние
- 61. Лечение: Химиотерапия. Лучевая терапия. Хирургический метод.
- 62. Наблюдение Физикальное обследование и лабораторные анализы выполняются : -каждые 3 месяца в течение 1 года, -
- 64. Скачать презентацию

























































 Опасность инфекционных заболеваний
Опасность инфекционных заболеваний Лекарственные средства, действующие на эфферентную иннервацию в области холинергических синапсов
Лекарственные средства, действующие на эфферентную иннервацию в области холинергических синапсов Medical faculty
Medical faculty Трихинеллез. Эпидемиология
Трихинеллез. Эпидемиология Системная красная волчанка
Системная красная волчанка Синдром внезапной детской смерти (СВДС)
Синдром внезапной детской смерти (СВДС) Седация в анестезиологии и интенсивной терапии
Седация в анестезиологии и интенсивной терапии Проблема Невынашивания: прегравидарная подготовка, ведение беременности
Проблема Невынашивания: прегравидарная подготовка, ведение беременности Острая ревматическая лихорадка у детей
Острая ревматическая лихорадка у детей Афазия
Афазия Болезнь Паркинсона
Болезнь Паркинсона Общая и экспериментальная психология. Деятельность
Общая и экспериментальная психология. Деятельность Стресс туралы Г. Сельенің ілімі. Эмоциялық стресс
Стресс туралы Г. Сельенің ілімі. Эмоциялық стресс Тромбофлебит поверхностных вен нижних конечностей
Тромбофлебит поверхностных вен нижних конечностей Наружное применение лекарственных средств
Наружное применение лекарственных средств Клиническая фармакогенетика
Клиническая фармакогенетика Профилактика вертикального пути передачи ВИЧ-инфекции. Особенности течения ВИЧ у детей
Профилактика вертикального пути передачи ВИЧ-инфекции. Особенности течения ВИЧ у детей Үй жұмысын тексеру. Есеп шығару
Үй жұмысын тексеру. Есеп шығару ЛФК кардиостимулятор
ЛФК кардиостимулятор Характерные симптомы, которые испытывают пациенты с опасными для жизни заболеванием (раны, жар, лимфедема)
Характерные симптомы, которые испытывают пациенты с опасными для жизни заболеванием (раны, жар, лимфедема) Мочевыделительная система
Мочевыделительная система Золотое правило этики
Золотое правило этики Заболевания желудочно-кишечного тракта
Заболевания желудочно-кишечного тракта Осложнения инфаркта миокарда
Осложнения инфаркта миокарда Восстановление подвижности тазобедренного сустава у лиц пожилого возраста после эндопротезирования
Восстановление подвижности тазобедренного сустава у лиц пожилого возраста после эндопротезирования Истмико-цервикальная недостаточность (ИЦН)
Истмико-цервикальная недостаточность (ИЦН) Расстройства памяти и интеллекта
Расстройства памяти и интеллекта CBL Аномалии рефракции
CBL Аномалии рефракции