Содержание
- 2. Метод Циля — Нельсена — метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий (возбудителей туберкулёза, микобактериозов, лепры),
- 3. Фри́дрих Не́льсен Фри́дрих Карл Адо́льф Не́льсен ( 29 марта 1854, — 11 апреля 1898) — немецкий
- 4. Франц Циль Франц Циль ( 1857 — 1926) — немецкий бактериолог, профессор в Любеке. Продолжая работы
- 5. Принцип Кислотоустойчивость микроорганизмов обусловлена наличием в их клетках липидов, воска и оксикислот. Такие микроорганизмы плохо окрашиваются
- 6. Приготовление растворов Раствор 1. Насыщенный спиртовой раствор фуксина: растереть в ступке 0,3 г основного фуксина с
- 7. Методы окраски
- 8. Микобактерии туберкулеза в мокроте (микроскопия). Окраска по Цилю-Нильсену. В поле зрения можно наблюдать палочки, окрашенные в
- 9. Порядок проведения микроскопического исследования При микроскопическом исследовании мазка, окрашенного по Циль-Нильсену, следует просматривать не менее 100
- 12. Скачать презентацию
Метод Циля — Нельсена
— метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий
Метод Циля — Нельсена
— метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий
Метод назван именами немецких медиков — микробиолога Франца Циля и патологоанатома Фридриха Нельсена, которые разработали его в 1882—1883 гг.
Фри́дрих Не́льсен
Фри́дрих Карл Адо́льф Не́льсен ( 29 марта 1854, — 11 апреля 1898) — немецкий патолог.
Изучал медицину
Фри́дрих Не́льсен
Фри́дрих Карл Адо́льф Не́льсен ( 29 марта 1854, — 11 апреля 1898) — немецкий патолог.
Изучал медицину
Умер от туберкулёза гортани[1].
Франц Циль
Франц Циль ( 1857 — 1926) — немецкий бактериолог, профессор в Любеке. Продолжая работы Пауля Эрлиха, Франц
Франц Циль
Франц Циль ( 1857 — 1926) — немецкий бактериолог, профессор в Любеке. Продолжая работы Пауля Эрлиха, Франц
Принцип
Кислотоустойчивость микроорганизмов обусловлена наличием в их клетках липидов, воска и оксикислот. Такие микроорганизмы плохо окрашиваются
Принцип
Кислотоустойчивость микроорганизмов обусловлена наличием в их клетках липидов, воска и оксикислот. Такие микроорганизмы плохо окрашиваются
АНАЛИЗИРУЕМЫЕ ОБРАЗЦЫ
Моча, мокрота, спинномозговая жидкость, серозные жидкости полостей.
Приготовление растворов
Раствор 1. Насыщенный спиртовой раствор фуксина:
растереть в ступке 0,3 г
Приготовление растворов
Раствор 1. Насыщенный спиртовой раствор фуксина:
растереть в ступке 0,3 г
Раствор 2. Рабочий раствор фенола (5 % водный раствор):
расплавить 5 г кристаллического фенола путём легкого подогревания на водяной бане. Добавить слегка подогретую дистиллированную воду до объема 100 мл.
Раствор 3. Рабочий раствор карболового фуксина:
в 90 мл полученного раствора фенола (2) добавить 10 мл насыщенного раствора фуксина.
Раствор 4. Обесцвечивающие растворы:
а) Раствор серной кислоты
К 75 мл дистиллированной воды осторожно долить 25 мл
концентрированной серной кислоты, постепенно наслаивая её по стенкам
сосуда. Смешать. Содержимое нагреется.
б) Раствор солянокислого спирта
Вместо раствора серной кислоты для обесцвечивания можно
использовать 3% солянокислый спирт: Этиловый спирт 96- 97 мл Концентрированная соляная кислота 3 мл. К 97 мл спирта осторожно добавляют 3 мл концентрированной соляной кислоты.
Раствор 5. Рабочий раствор метиленового синего:
растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной воды.
Методы окраски
Методы окраски
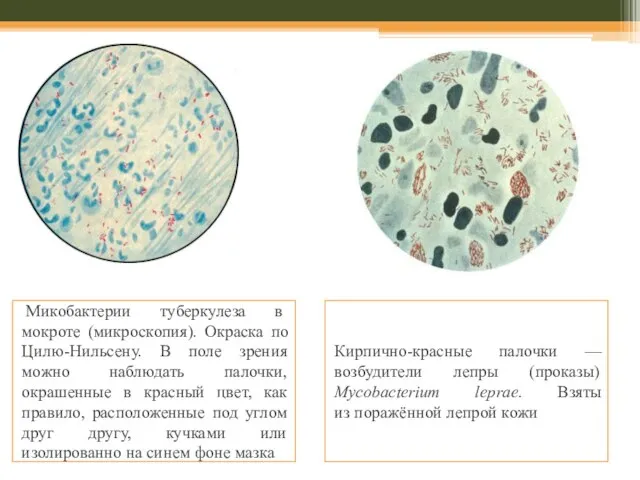
Микобактерии туберкулеза в мокроте (микроскопия). Окраска по Цилю-Нильсену. В поле зрения
Микобактерии туберкулеза в мокроте (микроскопия). Окраска по Цилю-Нильсену. В поле зрения
Кирпично-красные палочки —
возбудители лепры (проказы)
Mycobacterium leprae. Взяты
из поражённой лепрой кожи
Порядок проведения микроскопического исследования
При микроскопическом исследовании мазка, окрашенного по Циль-Нильсену, следует
Порядок проведения микроскопического исследования
При микроскопическом исследовании мазка, окрашенного по Циль-Нильсену, следует
либо 3 параллельных прохода по длине препарата;
либо 9 параллельных проходов по ширине.
Просматривать препарат начинают с левого верхнего выбранного в мазке поля зрения, постепенно передвигаясь либо вдоль продольной оси препарата до конца мазка, либо смещаясь вниз и затем вновь поднимаясь вверх и т. д., проходя все поля зрения до границы мазка. При увеличении микроскопа 1000x, то есть 100x для масляно-иммерсионного объектива и 10x для окуляра, при исследовании одной длины мазка (~ 20 мм) за один продольный проход просматривается около 100—120 полей зрения (диаметр поля зрения — 0,16 — 0,2 мм).








 Частная психопатология
Частная психопатология Вплив температури і вологості повітря на спортивну працездатність. Тренування в горах
Вплив температури і вологості повітря на спортивну працездатність. Тренування в горах Психология личности (темперамент и акцентуации)
Психология личности (темперамент и акцентуации) Стандарты диагностики туберкулеза в работе врача общей практики
Стандарты диагностики туберкулеза в работе врача общей практики Тахеометр
Тахеометр О мерах по обеспечению качества образцов
О мерах по обеспечению качества образцов Принципы рационального питания
Принципы рационального питания Бүйрек ауруларымен ауыратын балаларға диспансерлік бақылау жүргізу
Бүйрек ауруларымен ауыратын балаларға диспансерлік бақылау жүргізу Свёртывание крови. Переливание крови. Группы крови
Свёртывание крови. Переливание крови. Группы крови ВКР: Течение и лечение катаральных (альвеолярных) маститов в ООО «РУСЬ»
ВКР: Течение и лечение катаральных (альвеолярных) маститов в ООО «РУСЬ» Столбняк. Клиника. Диагностика. Лечение
Столбняк. Клиника. Диагностика. Лечение Xəstəxanadaxili infeksiyalar və onlarla mübarizənin əsasları, əksepidemik tədbirlər
Xəstəxanadaxili infeksiyalar və onlarla mübarizənin əsasları, əksepidemik tədbirlər Функциональные заболевания желудочно-кишечного тракта у детей
Функциональные заболевания желудочно-кишечного тракта у детей Многоформная экссудативная эритема
Многоформная экссудативная эритема Экссудативті-катаральды диатез
Экссудативті-катаральды диатез Денсаулық-2020 бағдарламасы
Денсаулық-2020 бағдарламасы Жедел сол қарыншалық жетіспеушілік кезіндегі алгоритм
Жедел сол қарыншалық жетіспеушілік кезіндегі алгоритм Пульпит. Классификация пульпита
Пульпит. Классификация пульпита Кроссворд на тему: Болезни дыхательной системы
Кроссворд на тему: Болезни дыхательной системы Науқастың ауруға деген психологиялық жауабы
Науқастың ауруға деген психологиялық жауабы Синдром беспокойных ног
Синдром беспокойных ног Тремор и современные виды лечения
Тремор и современные виды лечения Диетическое питание
Диетическое питание Общие вопросы оценивания и интерпретации результатов
Общие вопросы оценивания и интерпретации результатов Вплив алкоголю на дітей та підлітків
Вплив алкоголю на дітей та підлітків Психолого-педагогічна характеристика і освіта дітей з порушеннями опорно-рухового апарату та дітей з порушеннями мовлення
Психолого-педагогічна характеристика і освіта дітей з порушеннями опорно-рухового апарату та дітей з порушеннями мовлення Явление близнецовости у человека. Близнецы как особая группа людей. Особенности воспитания и развития близнецов
Явление близнецовости у человека. Близнецы как особая группа людей. Особенности воспитания и развития близнецов Практические аспекты применения ингибиторов PCSK-9 у пациентов высокого и очень высокого сердечно-сосудистого риска
Практические аспекты применения ингибиторов PCSK-9 у пациентов высокого и очень высокого сердечно-сосудистого риска