Содержание
- 2. Вирусный гепатит С (В 17.1) Антропонозная инфекционная болезнь с гемоконтактным механизмом передачи возбудителя, характеризующаяся легким или
- 3. Заболеваемость вирусными гепатитами в РФ (2020 г.) Острый вирусный гепатит А 4165 /2,84 Острый гепатит В
- 4. Актуальность ХГС в мире HCV является причиной 20% острого вирусного гепатита; 70% хронического вирусного гепатита; 65%
- 5. ВОЗ: на пути к элиминации ВГС
- 6. Особенности вируса гепатита С Вирус содержит одноцепочечную РНК и 3 струк- турных АГ: нуклеокапсидный белок (С-соrе),
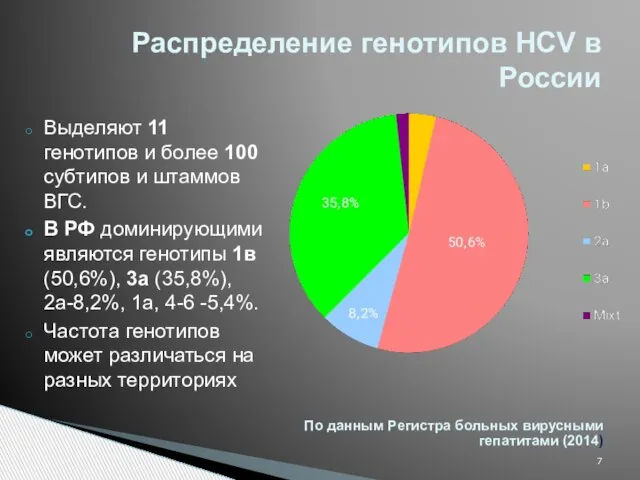
- 7. Распределение генотипов HCV в России Выделяют 11 генотипов и более 100 субтипов и штаммов ВГС. В
- 8. Эпидемиология HCV передается чаще парентерально. Доля посттрансфузионного гепатита С составляет от 20 до 80% в различных
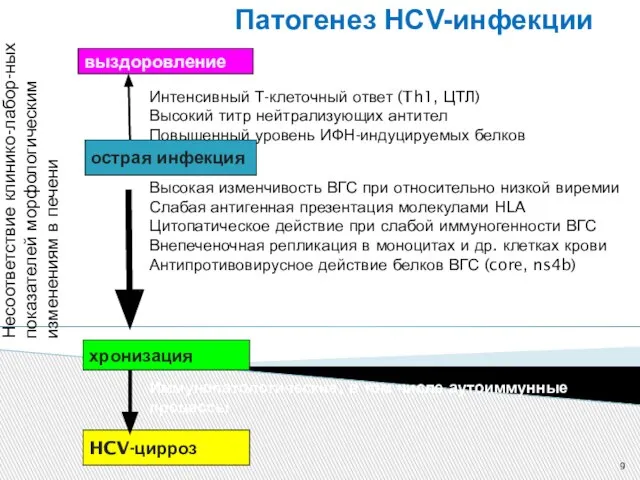
- 9. Патогенез HCV-инфекции выздоровление острая инфекция хронизация HCV-цирроз Интенсивный Т-клеточный ответ (Th1, ЦТЛ) Высокий титр нейтрализующих антител
- 10. Вирусный гепатит С, острая фаза данных эпидемиологического анамнеза (парентеральные манипуляции, включая внутривенное введение психоактивных препаратов, переливание
- 11. Диагностика ВГС Серологические методы – определение специфических антител к HCV класса IgG или суммарных IgG и
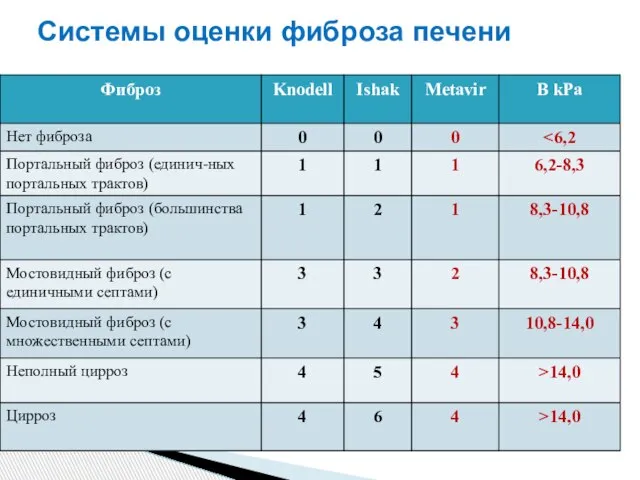
- 12. Системы оценки фиброза печени
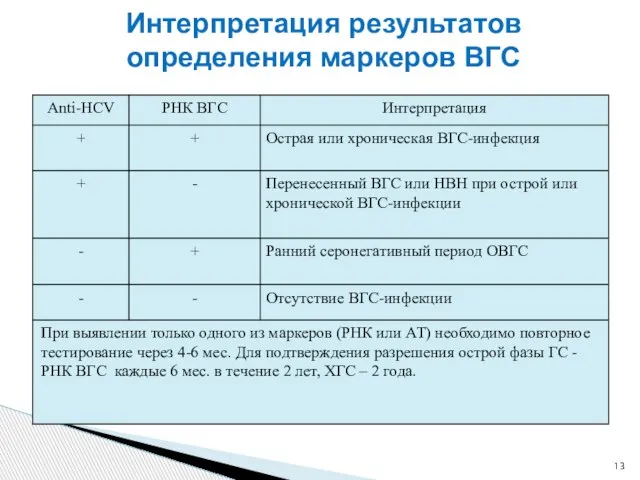
- 13. Интерпретация результатов определения маркеров ВГС
- 14. Этиотропная терапия ОГС ПВТ может быть отложена на 8–12 нед от начала заболевания (отсрочка допустима в
- 15. СП 3.1.3112-13 «Профилактика ВГС» Диспансеризация реконвалесцентов ВГС Реконвалесценты ОГС проходят осмотр и лабораторное обследование, включая РНК
- 16. СП 3.1.3112-13 «Профилактика ВГС» При выявлении anti-HCV IgG и (или) РНК вируса ГС пациент в течение
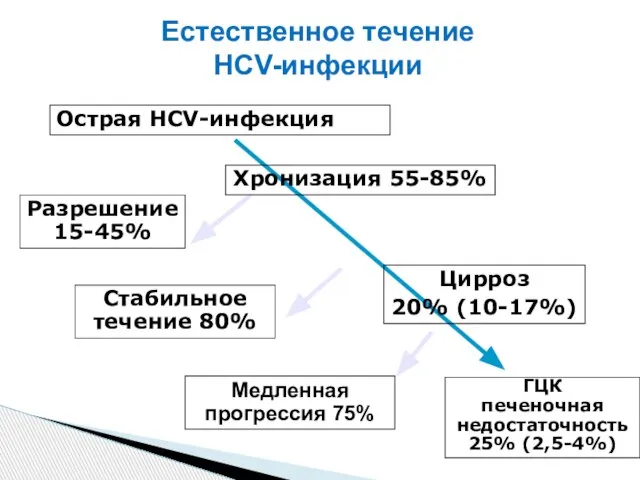
- 17. Естественное течение HCV-инфекции Стабильное течение 80% ГЦК печеночная недостаточность 25% (2,5-4%) Медленная прогрессия 75% Разрешение 15-45%
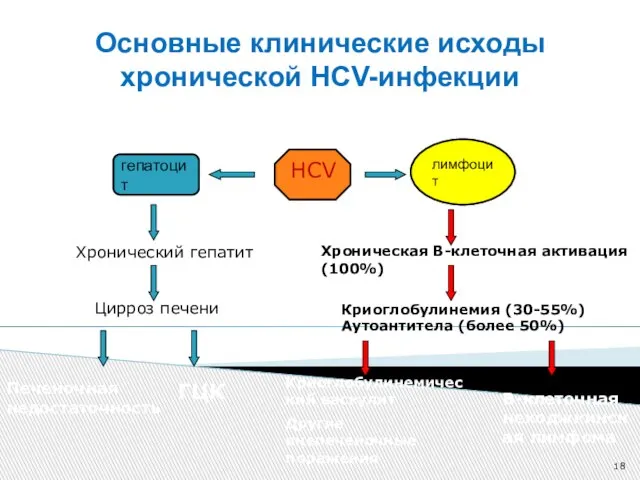
- 18. Основные клинические исходы хронической HCV-инфекции лимфоцит гепатоцит HCV Хронический гепатит Цирроз печени Печеночная недостаточность ГЦК Хроническая
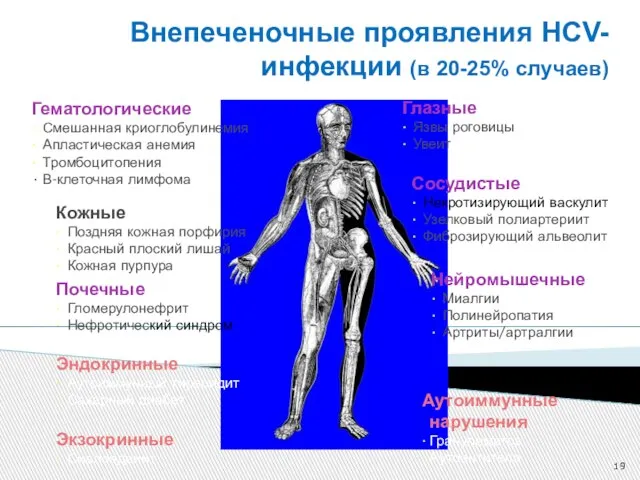
- 19. Внепеченочные проявления HCV-инфекции (в 20-25% случаев) Гематологические Смешанная криоглобулинемия Апластическая анемия Тромбоцитопения • В-клеточная лимфома Кожные
- 20. HCV-инфекция – мультисистемное заболевание Васкулит Гломерулонефрит Периферическая нейропатия Узелковый периартериит Артриты Синдром Шегрена Криоглобулинемия Стеатоз печени,
- 21. Хроническая HCV-инфекция достоверно увеличивает риск смерти от соматических заболеваний
- 22. Кофакторы прогрессирования ХГС и среднее время развития ЦП ВИЧ-инфекция 9 лет Алкоголь >50 г/сут 13,5 лет
- 23. Частота выявления анти- ВГС у ВИЧ-инфицированных лиц (в %)
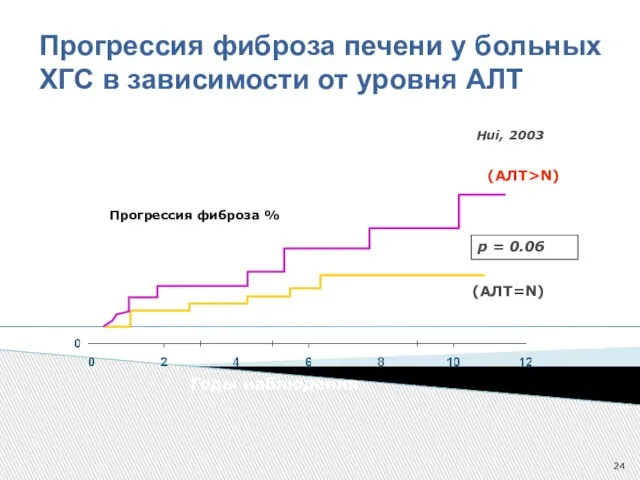
- 24. Прогрессия фиброза печени у больных ХГС в зависимости от уровня АЛТ Прогрессия фиброза % Годы наблюдения
- 25. Факторы высокого риска развития ГЦК возраст > 50 лет мужской пол высокая гистологическая активность тяжелый фиброз
- 26. Порядок диспансерного наблюдения пациентов ХВГВ и С В большинстве случаев ВГС имеет латентное течение и симптомы
- 27. Показания к лечению HCV-инфекции Острый гепатит С Хронический гепатит С Цирроз печени класса А, В, С
- 28. Цель и задачи противовирусной терапии ВГС Элиминация вируса из организма (достижение устойчивого вирусологического ответа) Разрешение воспалительной
- 29. EASL: Recommendations on Treatment of Hepatitis C 2020
- 30. Все больные ХГС (РНК HCV+), вне зависимости от стадии фиброза, уровня АЛТ, генотипа вируса Если ресурсы
- 31. Маркеры репликации: RNA HCV, генотип; Активность воспалительного процесса в печени (уровень АЛТ, тимоловая проба, диспротеинемия). Степень
- 32. Противопоказания для назначения интерферонотерапии при ХГС Больные с ЦП класса В и С по Чайлд-Пью Беременность
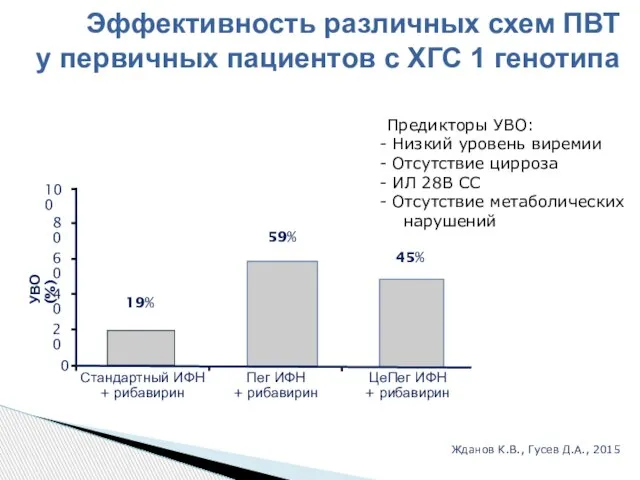
- 33. Эффективность различных схем ПВТ у первичных пациентов с ХГС 1 генотипа Жданов К.В., Гусев Д.А., 2015
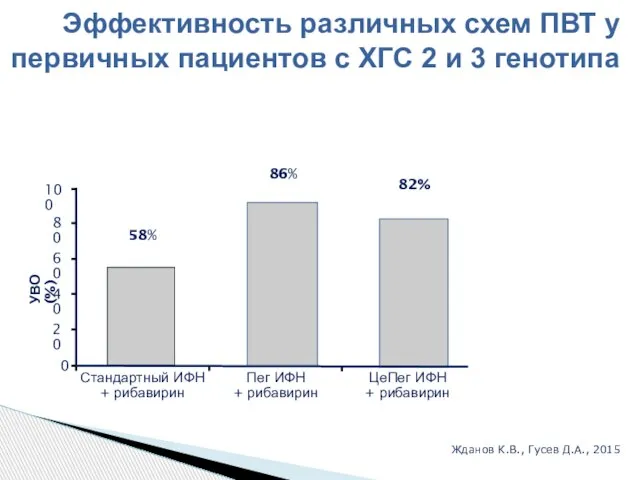
- 34. Эффективность различных схем ПВТ у первичных пациентов с ХГС 2 и 3 генотипа Жданов К.В., Гусев
- 35. Наблюдение за пациентами, получающими интерферонотерапию HCV RNA: на сроках 4, 12, 24 и 48 недель лечения
- 36. Нежелательные явления интерфероно- терапии (пег-ИФН + рибавирин) Раздражительность (30%) Депрессия (31-34%) Гриппоподобные симптомы Сыпь и зуд
- 37. Этапы контроля противовирусной терапии ХГС Этап 1 4 недели ПВТ - быстрый вирусологический ответ (БВО) Этап
- 38. Коррекция побочных эффектов ПВТ
- 39. Коррекция дозы ПегИФН и рибавирина Дозу ПегИФН рекомендуется снижать ступенчато: Для ПегИФН α-2а : 180 –
- 40. Коррекция нейтропении на фоне ПВТ HCV-инфекции Ликопид по 10 мг 1 раз в день (утром, под
- 41. Наблюдение за лицами, достигшими УВО после ПВТ препаратами ИФН Пациенты, достигшие УВО после ПВТ, должны быть
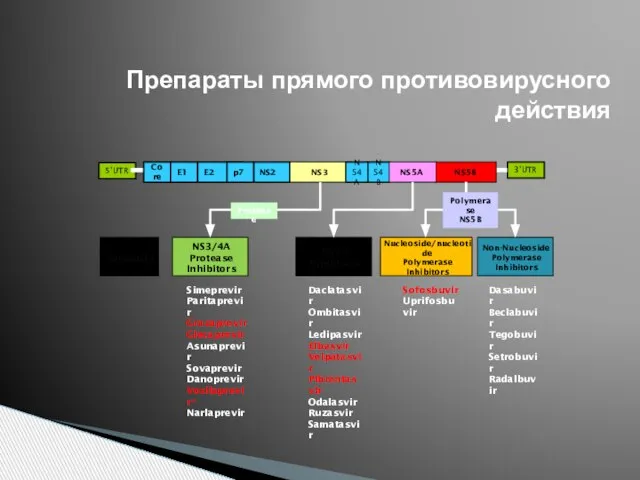
- 42. Препараты прямого противовирусного действия 3’UTR 5’UTR Core E1 E2 NS2 NS4B NS3 NS5A NS5B Simeprevir Paritaprevir
- 43. Новые цели противовирусной терапии Повысить эффективность ПВТ противовирусными препаратами прямого действия (ПППД)– добиться УВО не менее
- 44. Терапия хронической HCV-инфекции Безинтерфероновые схемы терапии являются наилуч-шим выбором в связи с их вирусологической эффектив-ностью, удобством
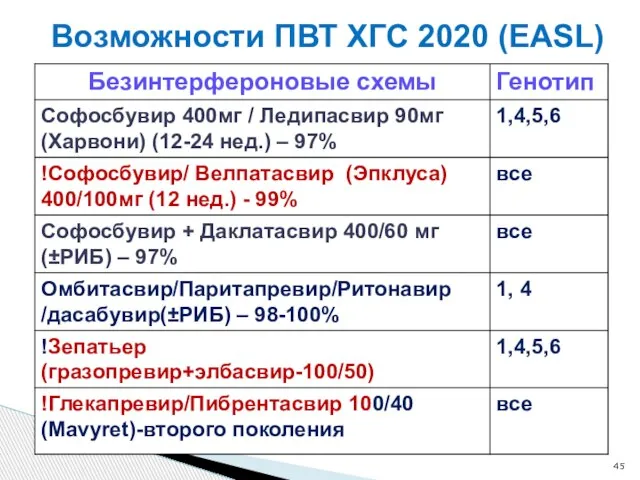
- 45. Возможности ПВТ ХГС 2020 (EASL)
- 46. Софосбувир/Велпатасвир (Epclusa) первый пангенотипный препарат для лечения ХГС
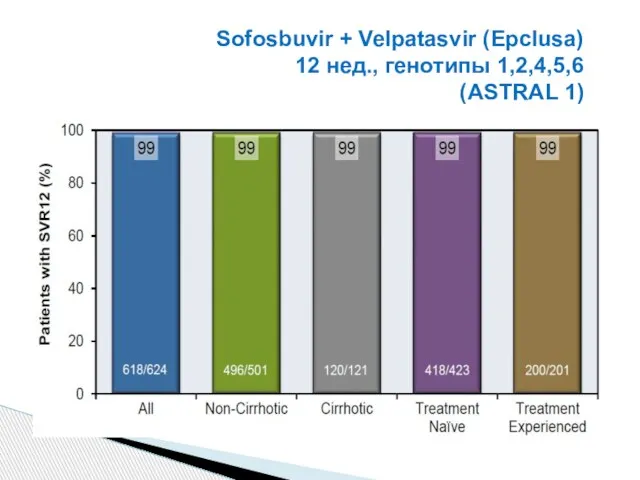
- 47. Sofosbuvir + Velpatasvir (Epclusa) 12 нед., генотипы 1,2,4,5,6 (ASTRAL 1)
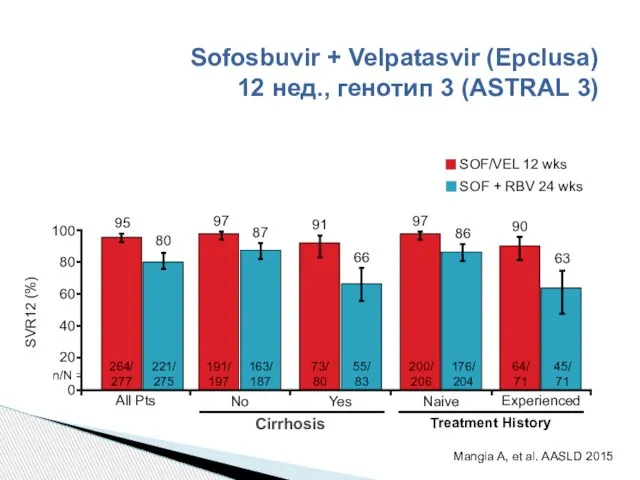
- 48. 100 Sofosbuvir + Velpatasvir (Epclusa) 12 нед., генотип 3 (ASTRAL 3) Mangia A, et al. AASLD
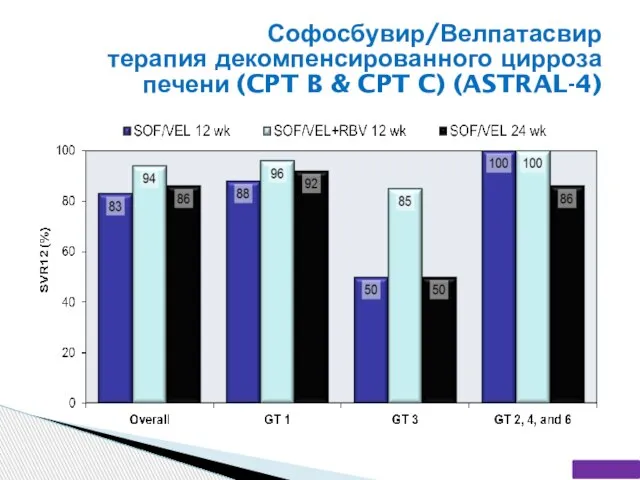
- 49. Софосбувир/Велпатасвир терапия декомпенсированного цирроза печени (CPT B & CPT C) (ASTRAL-4)
- 50. Каков портрет “трудного” пациента с ХГС? Неудача предшествующего лечения безинтерфероновыми схемами Сопутствующая патология (ХБП и др.)
- 51. Глекапревир/Пибрентасвир (Mavyret®) пангенотипический ПППД второго поколения Зарегистрирован в РФ в мае 2018 г. 100 мг 40
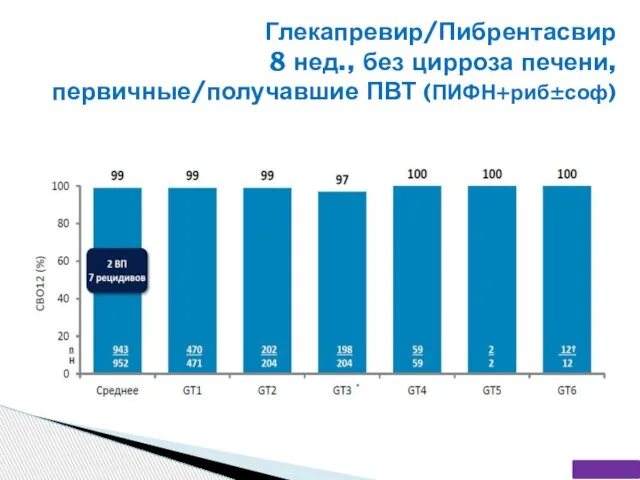
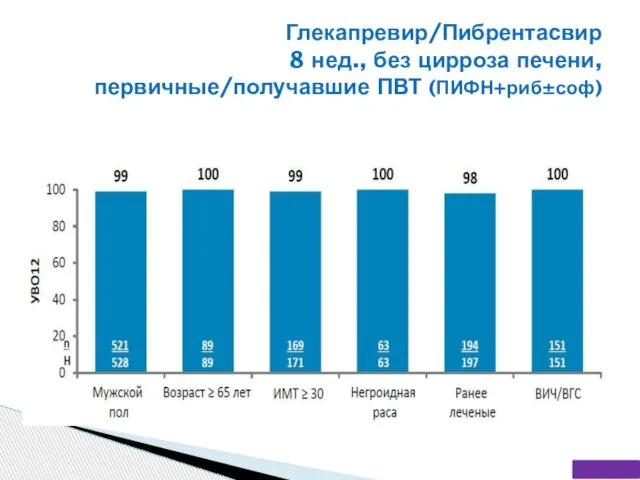
- 52. Глекапревир/Пибрентасвир 8 нед., без цирроза печени, первичные/получавшие ПВТ (ПИФН+риб±соф)
- 53. Глекапревир/Пибрентасвир 8 нед., без цирроза печени, первичные/получавшие ПВТ (ПИФН+риб±соф)
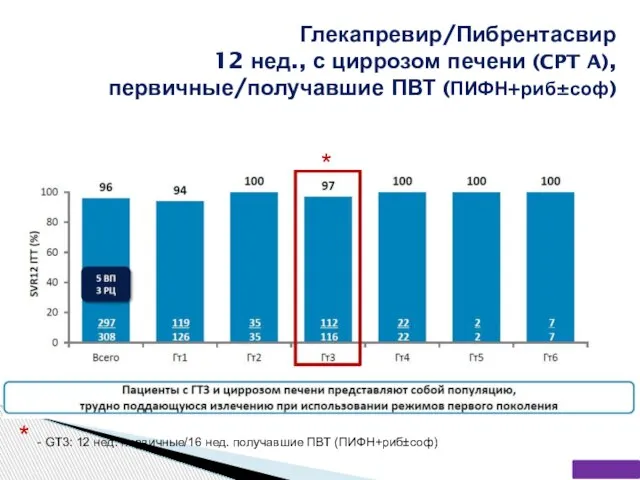
- 54. Глекапревир/Пибрентасвир 12 нед., с циррозом печени (CPT A), первичные/получавшие ПВТ (ПИФН+риб±соф) * * - GT3: 12
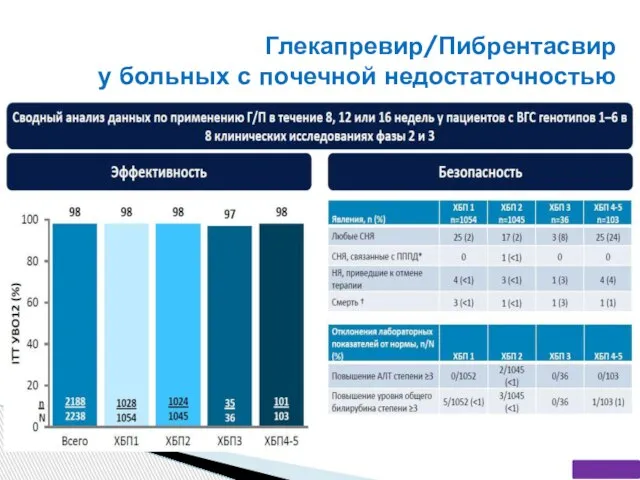
- 55. Глекапревир/Пибрентасвир у больных с почечной недостаточностью
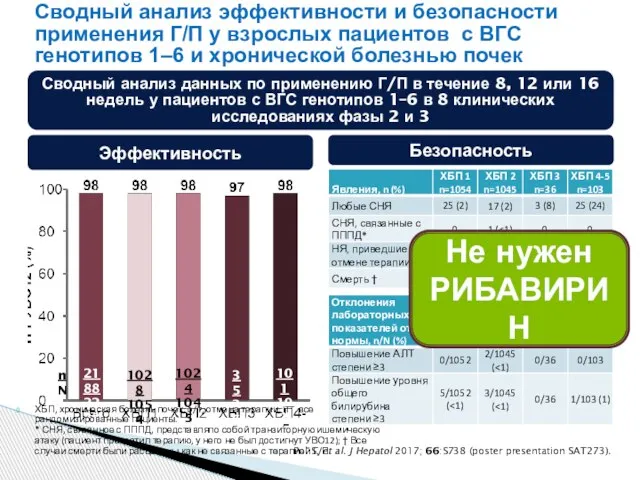
- 56. Сводный анализ эффективности и безопасности применения Г/П у взрослых пациентов с ВГС генотипов 1–6 и хронической
- 57. ГТ: 1 (57%), 2 (13%), 3 (24%), 4–6 (6%) Фиброз: F0–1 (80%), F2 (6%), F3 (14%)
- 58. Гразопревир/Элбасвир (Zepatier®) Зарегистрирован в РФ в сентябре 2018 г.
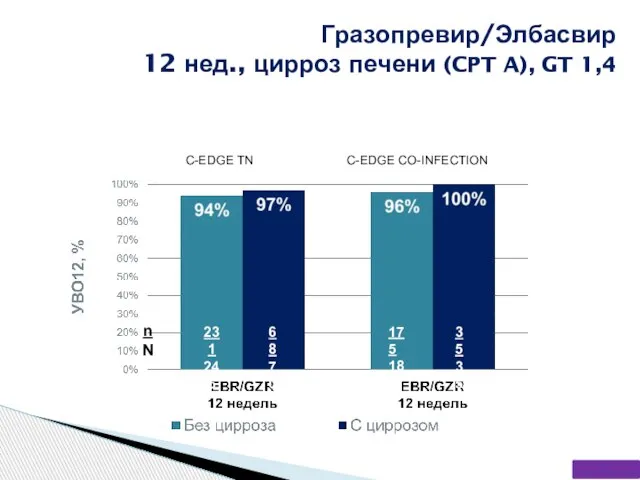
- 59. Гразопревир/Элбасвир 12 нед., цирроз печени (CPT A), GT 1,4 C-EDGE TN C-EDGE CO-INFECTION
- 60. Гразопревир/Элбасвир 12 нед., цирроз печени (CPT A), GT 1,4, получавшие ПВТ (ПИФН+риб±соф)
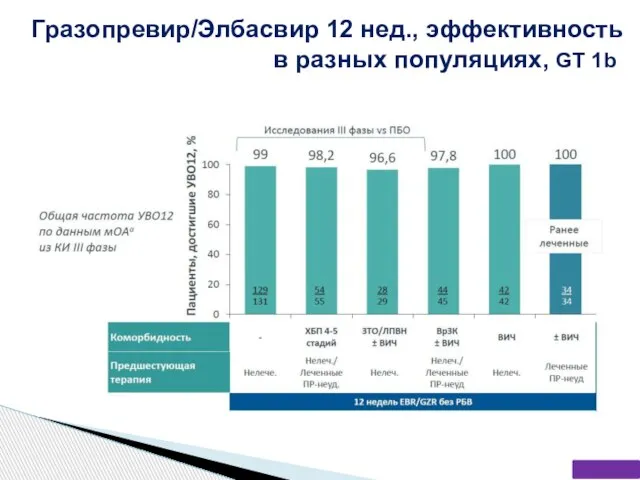
- 61. Гразопревир/Элбасвир 12 нед., эффективность в разных популяциях, GT 1b
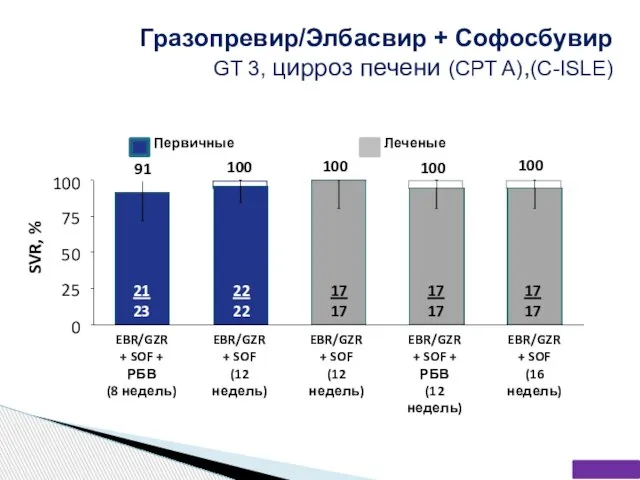
- 62. 21 23 22 22 17 17 17 17 17 17 Первичные Леченые 91 100 100 100
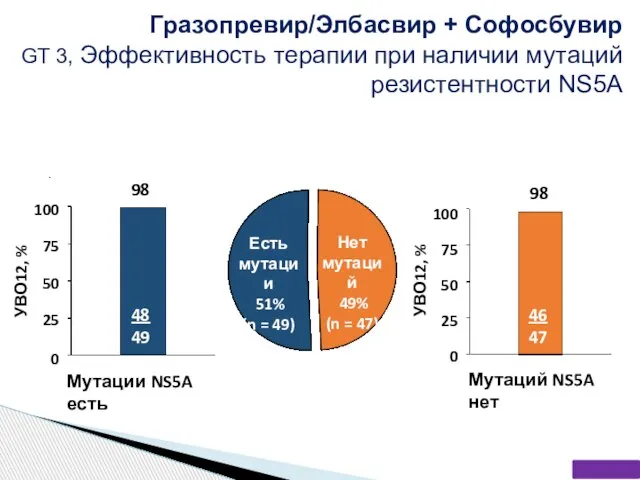
- 63. Гразопревир/Элбасвир + Софосбувир GT 3, Эффективность терапии при наличии мутаций резистентности NS5A 48 49 Есть мутации
- 64. Гразопревир/Элбасвир 12 нед., GT 1, Эффективность при почечной недостаточности 4-5 ст. (C-SURFER)
- 65. Лечение ХГС у пациентов с почечной недостаточностью, в т.ч. у пациентов, находящихся на гемодиализе EASL: Recommendations
- 66. Интерфероны в ведущих мировых рекомендациях по лечению ХГС
- 67. Лечение хронического гепатита С у подростков и детей EASL: Recommendations on Treatment of Hepatitis C 2020
- 68. Лечение хронического гепатита С у подростков и детей EASL: Recommendations on Treatment of Hepatitis C 2020
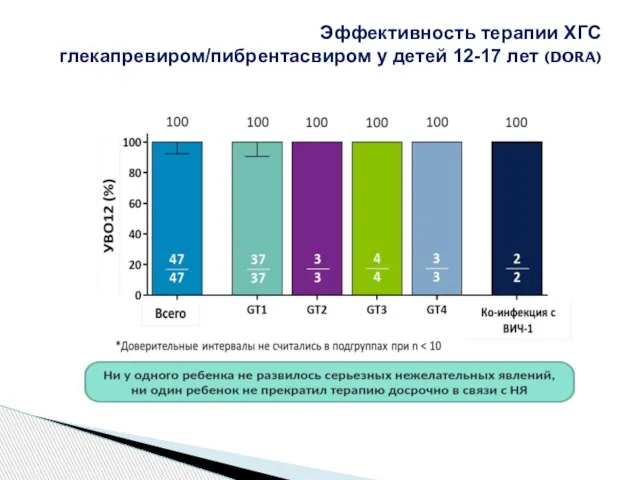
- 69. Эффективность терапии ХГС глекапревиром/пибрентасвиром у детей 12-17 лет (DORA)
- 70. 356 пациентов (77%) применяли сопутствующую терапию Всего 1329 назначений (260 препаратов) Оценка риска МЛВ для шести
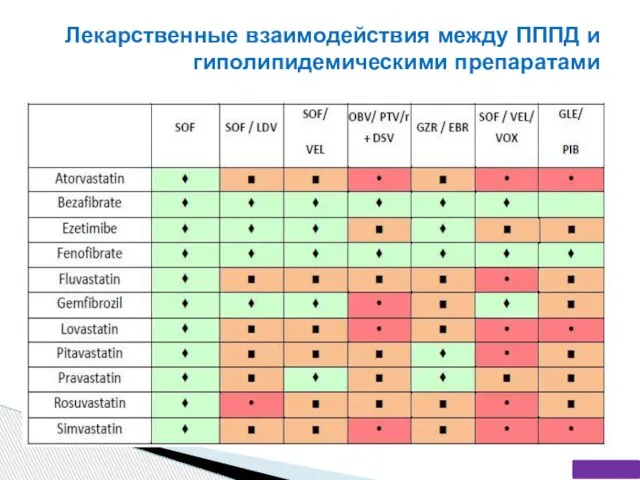
- 71. Лекарственные взаимодействия между ПППД и гиполипидемическими препаратами
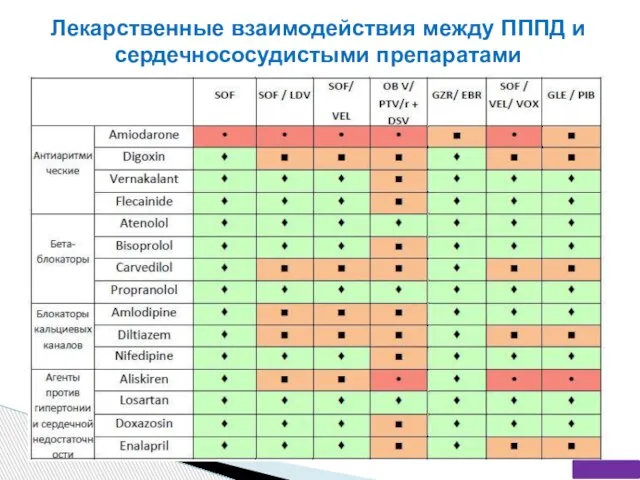
- 72. Лекарственные взаимодействия между ПППД и сердечнососудистыми препаратами
- 73. Лекарственные взаимодействия между ПППД и пероральными антитромбоцитарными препаратами и антикоагулянтами
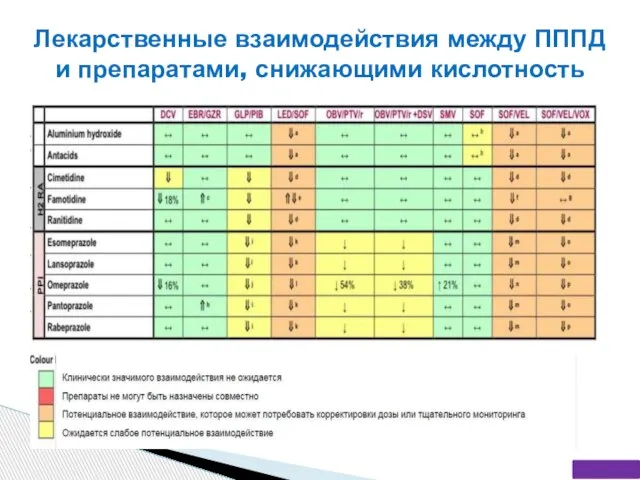
- 74. Лекарственные взаимодействия между ПППД и препаратами, снижающими кислотность
- 75. Мониторинг эффективности без-интерфероновой терапии ХГС (AASLD, 2016) Определение РНК вируса ГС через 4 недели, при отсутствии
- 76. Посттерапевтическое наблюдение лиц, достигших УВО 1. Пациенты без цирроза печени: повторное определение АЛТ и РНК ВГС
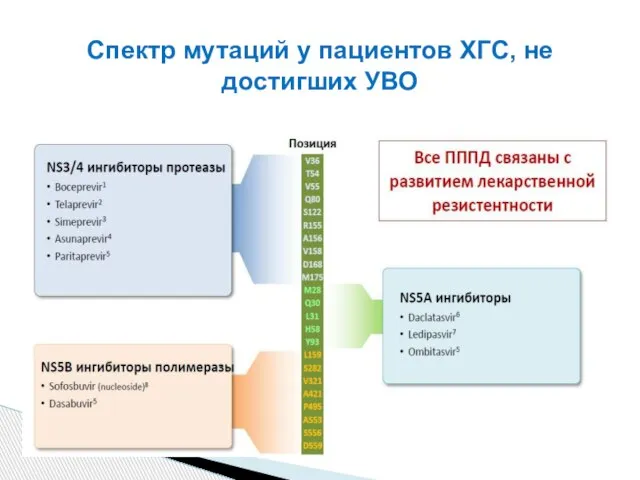
- 77. Спектр мутаций у пациентов ХГС, не достигших УВО
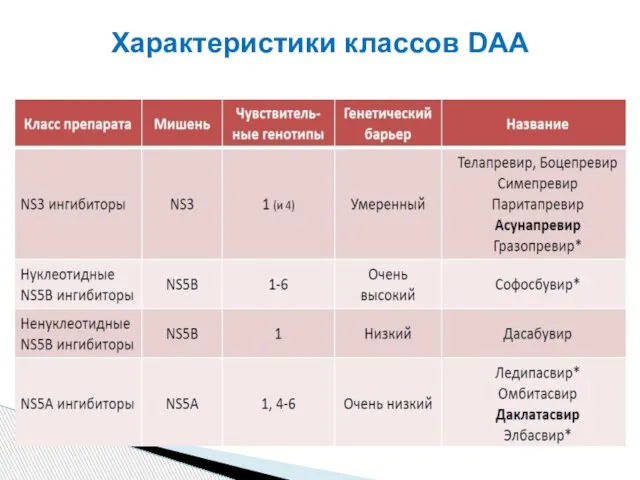
- 78. Характеристики классов DAA
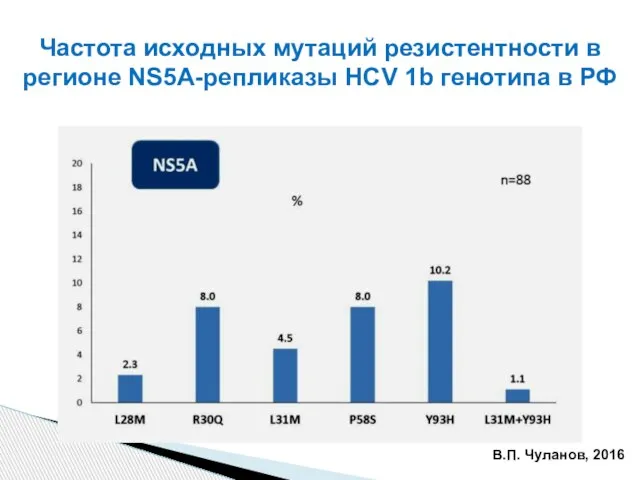
- 79. Частота исходных мутаций резистентности в регионе NS5A-репликазы HCV 1b генотипа в РФ В.П. Чуланов, 2016
- 80. Когда проводить исследование на мутации резистентности Исследование на мутации, вероятно, не требуется в группах пациентов при
- 81. Общие принципы повторного лечения у пациентов с мутациями резистентности Сменить класс DAA Включить в схему лечения
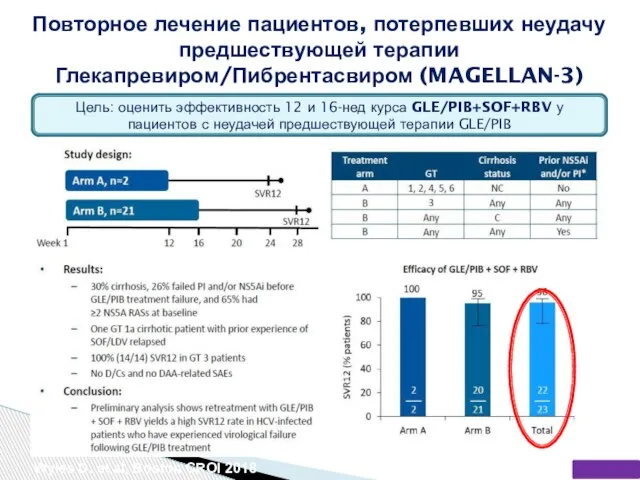
- 82. Повторное лечение пациентов, потерпевших неудачу предшествующей терапии Глекапревиром/Пибрентасвиром (MAGELLAN-3) Wyles D. et al, Boston CROI 2018
- 83. Рекомендации AASLD/IDSA и EASL для больных с декомпенсированным циррозом печени, повторное лечение ^ препарат не зарегистрирован
- 84. Заключение Все пациенты ХГС, как первичные, так и потерпевшие неудачу ПВТ, являются кандидатами на получение ПППД
- 86. Скачать презентацию



















































 Лёгкие (pulmo)
Лёгкие (pulmo) Болезни пищеварительного тракта
Болезни пищеварительного тракта Гуморальная регуляция физиологических функций
Гуморальная регуляция физиологических функций Табан күмбездері. Жалпақтабандылықт
Табан күмбездері. Жалпақтабандылықт АФО почек и мочевыделительной системы у детей
АФО почек и мочевыделительной системы у детей Стратегия формирующего эксперимента
Стратегия формирующего эксперимента Диагностика и лечение цистиноза
Диагностика и лечение цистиноза Миома матки
Миома матки Презентация Лекция 1
Презентация Лекция 1 Мочевыделительная система человека
Мочевыделительная система человека Распределение нагрузки на мышцы коленного сустава человека при выполнении реабилитационных упражнений
Распределение нагрузки на мышцы коленного сустава человека при выполнении реабилитационных упражнений Методы регистрации электрической активности головного мозга человека
Методы регистрации электрической активности головного мозга человека ЖИТС. Жұқтырылған иммун тапшылығы синдромының профилактикасы және оған қарсы күрес жөніндегі орталықтардың қызметі
ЖИТС. Жұқтырылған иммун тапшылығы синдромының профилактикасы және оған қарсы күрес жөніндегі орталықтардың қызметі Всемирная неделя иммунизации, 2019 г
Всемирная неделя иммунизации, 2019 г Краснуха, корь. Острая вирусная инфекция
Краснуха, корь. Острая вирусная инфекция Нарушения речи центральные и периферические
Нарушения речи центральные и периферические Викторина Правильная еда
Викторина Правильная еда Акушериядағы іріңді –септикалық асқынудың өзекті мәселелері
Акушериядағы іріңді –септикалық асқынудың өзекті мәселелері Возбудители эшерихиозов и шигеллёзов
Возбудители эшерихиозов и шигеллёзов Контейнування як вид психологічної допомоги
Контейнування як вид психологічної допомоги Теоретические основы психологического консультирования
Теоретические основы психологического консультирования Острый аппендицит
Острый аппендицит Балалар стоматологиялық тәжірибесіндегі түбір өзектерін уақытша және тұрақты обтурациялауда, қолданылатын силлерлер
Балалар стоматологиялық тәжірибесіндегі түбір өзектерін уақытша және тұрақты обтурациялауда, қолданылатын силлерлер Какова роль воды в жизни человека
Какова роль воды в жизни человека Histologická technika 1
Histologická technika 1 Акмеология как условие повышения качества образования
Акмеология как условие повышения качества образования Типы высшей нервной деятельности
Типы высшей нервной деятельности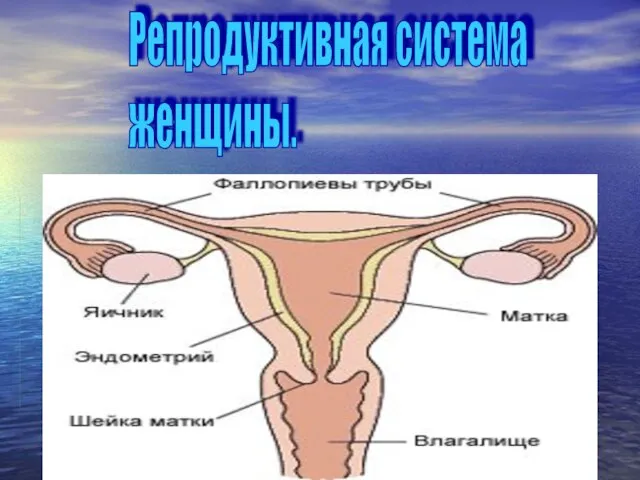 Репродуктивная система женщины
Репродуктивная система женщины