Содержание
- 2. McMurry J.E., Rico J.G., Shih Y.N. Tetrahedron Lett. 1989. V. 30. № 10. P. 1173. Tius
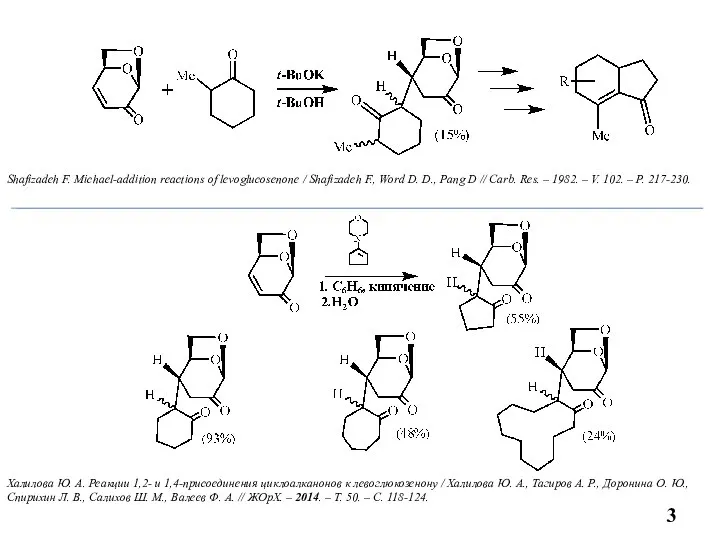
- 3. Shafizadeh F. Michael-addition reactions of levoglucosenone / Shafizadeh F., Word D. D., Pang D // Carb.
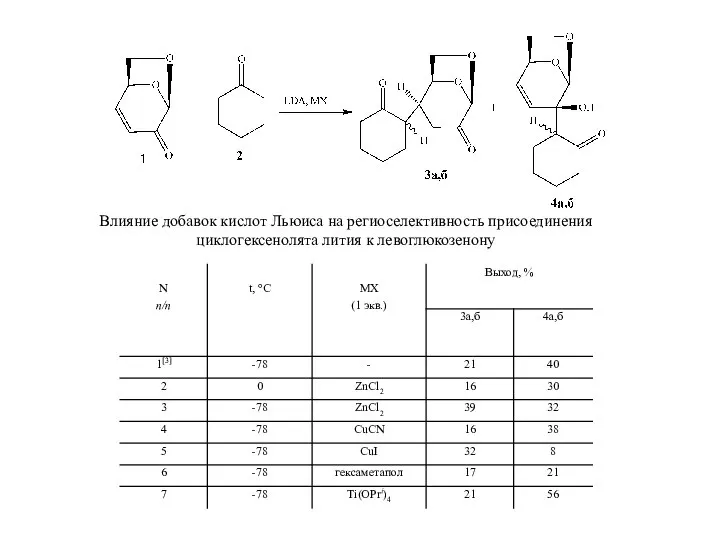
- 4. Влияние добавок кислот Льюиса на региоселективность присоединения циклогексенолята лития к левоглюкозенону
- 5. Влияние добавок кислот Льюиса на региоселективность присоединения циклододеценолята лития к левоглюкозенону
- 8. Об образовании тетрациклического соединения в спектре ЯМР 13С свидетельствуют сигналы атома четвертичного атома углерода 12-С при
- 9. ВЫВОДЫ 1. Оптимальным путем получения аддуктов Михаэля левоглюкозенона с циклогексаноном и -додеканоном является взаимодействие енолятов лития
- 10. Благодарю за внимание!
- 12. Скачать презентацию







 Компания Pilot. Системы для жизни и бизнеса
Компания Pilot. Системы для жизни и бизнеса Поисково-краеведческий материал Донбасс – мой родной край
Поисково-краеведческий материал Донбасс – мой родной край Правила гигиены в изменившихся условиях
Правила гигиены в изменившихся условиях Интерактивная игра в Power Point
Интерактивная игра в Power Point Лишь вера одна никогда не бывает одна
Лишь вера одна никогда не бывает одна Итоговая аттестация по истории: проблемы и перспективы
Итоговая аттестация по истории: проблемы и перспективы Опера-былина Садко. Николай Римский-Корсаков
Опера-былина Садко. Николай Римский-Корсаков Источники и рецепторы электромагнитных помех
Источники и рецепторы электромагнитных помех Основы и стратегии
Основы и стратегии 20151106_vse_nachinaetsya_s_lyubvi_prezentatsiya
20151106_vse_nachinaetsya_s_lyubvi_prezentatsiya Двигатель Фарадея
Двигатель Фарадея System studiów: „stacjonarne I stopnia”
System studiów: „stacjonarne I stopnia” Метаболизм – основа существования клетки
Метаболизм – основа существования клетки Посуда
Посуда Элементы схем. Полупроводниковый выпрямительный диод. Биполярные транзисторы
Элементы схем. Полупроводниковый выпрямительный диод. Биполярные транзисторы Сланцевая революция и ее международно-политические последствия
Сланцевая революция и ее международно-политические последствия Структура газотранспортной системы ЗАО ИЦА
Структура газотранспортной системы ЗАО ИЦА Остров Олимпия
Остров Олимпия Подход к работе бренда Hvilina с международными медиа
Подход к работе бренда Hvilina с международными медиа Полине на 14 февраля
Полине на 14 февраля Пищеварение в тонкой и толстой кишке. Всасывание. Моторная функция пищеварительного тракта
Пищеварение в тонкой и толстой кишке. Всасывание. Моторная функция пищеварительного тракта Chronique culturelle. Аudio
Chronique culturelle. Аudio Применение отходов дробления в цементобетонных дорожных основаниях автомобильных дорог
Применение отходов дробления в цементобетонных дорожных основаниях автомобильных дорог Христос - наша Праведность (Оправдание) и наше Освящение - 4
Христос - наша Праведность (Оправдание) и наше Освящение - 4 Сложные предложения
Сложные предложения Алгоритмы траекторной обработки данных
Алгоритмы траекторной обработки данных Достижения на разных этапах развития материаловедения
Достижения на разных этапах развития материаловедения Галерея великих женщин
Галерея великих женщин