Содержание
- 2. 1. Описывать элемент следует по 7 пунктам
- 7. 1. Состав высшего оксида, его характер (основный, кислотный, амфотерный)
- 8. 1. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
- 10. Увеличивается заряд ядра Увеличивается радиус атома Восстановительные свойства усиливаются Окислительные свойства ослабевают
- 12. Увеличивается заряд ядра Уменьшается радиус атома Восстановительные свойства ослабевают Окислительные свойства усиливаются
- 14. Металлические свойства усиливаются Металлические свойства ослабевают Неметаллические свойства усиливаются Неметаллические свойства ослабевают
- 15. Основные свойства ослабевают Основные свойства усиливаются Кислотные свойства ослабевают Кислотные свойства усиливаются
- 17. Порядковый номер 11 Массовое число 23 (А = 23) Заряд ядра +11 Z = +11 В
- 18. Na ) ) ) 2 8 1 Восстановительные свойства Металл
- 19. Металлическая химическая связь Металлическая кристаллическая решетка Металлический блеск Пластичность Тепло и – электропроводность
- 21. Na2O Основный оксид Реагирует с кислотами Реагирует с кислотными оксидами Реагирует с водой Оксид натрия Гидроксид
- 22. Порядковый номер 15 Массовое число 31 (А = 31) Заряд ядра +15 Z = +15 В
- 23. Р ) ) ) 2 8 5
- 24. Р Фосфор Окислитель Р0 + 3 ē → Р-3 Восстановитель Р0 - 3 ē → Р+3
- 25. Фосфор – неметалл Характерно явление аллотропии Белый фосфор Красный фосфор Чёрный фосфор
- 28. Скачать презентацию

























 Молярный объём. Относительная плотность
Молярный объём. Относительная плотность Насыпная плотность, методы определения, примеры
Насыпная плотность, методы определения, примеры Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей
Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей Экологическая оценка качества воды поверхностных водоемов г. Донецка
Экологическая оценка качества воды поверхностных водоемов г. Донецка Реакции электрофильного замещения
Реакции электрофильного замещения Спиртзавод ОАО «Петровский»
Спиртзавод ОАО «Петровский» Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Химические волокна. Свойства и технология производства
Химические волокна. Свойства и технология производства Алюминий. Химические свойства
Алюминий. Химические свойства Проантоцианидины. Антиоксидантные и антирадикальные свойства
Проантоцианидины. Антиоксидантные и антирадикальные свойства Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт) Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Формы выделения минералов
Формы выделения минералов Циклоалканы
Циклоалканы Основные классы неорганических соединений
Основные классы неорганических соединений Синтез Aspergillin PZ
Синтез Aspergillin PZ Биологические катализаторы
Биологические катализаторы Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Презентация по Химии "Электролитическая диссоциация веществ" - скачать смотреть
Презентация по Химии "Электролитическая диссоциация веществ" - скачать смотреть  Основные стратегии регуляции метаболических путей
Основные стратегии регуляции метаболических путей Металдардың тұздармен реакциялары
Металдардың тұздармен реакциялары Кислород. Получение кислорода и его физические свойства
Кислород. Получение кислорода и его физические свойства Электролиз воды
Электролиз воды Функциональный анализ ОВ
Функциональный анализ ОВ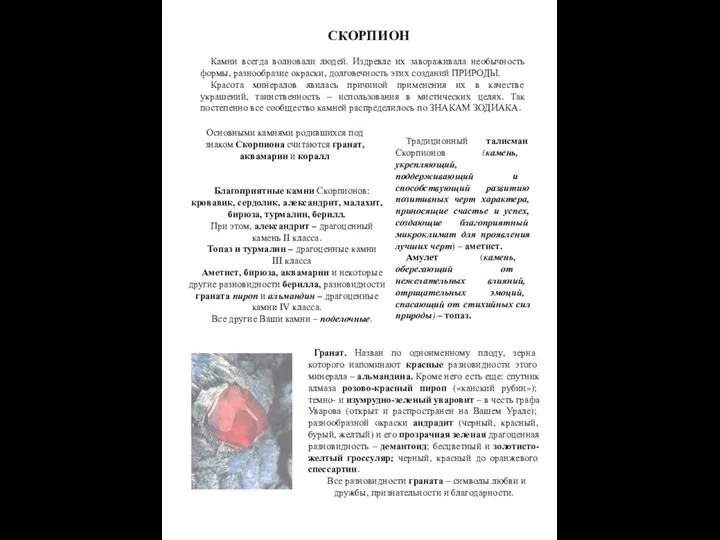 Камни и Скорпион
Камни и Скорпион Органічні сполуки. Вплив на організм людини Учениця 11-Б класу Колчаг Юлія
Органічні сполуки. Вплив на організм людини Учениця 11-Б класу Колчаг Юлія  Ситуационная задача по биохимии
Ситуационная задача по биохимии