Содержание
- 2. АРЕНЫ Ароматические соединения, или арены, — большая группа соединений карбоциклического ряда, молекулы которых содержат устойчивую циклическую
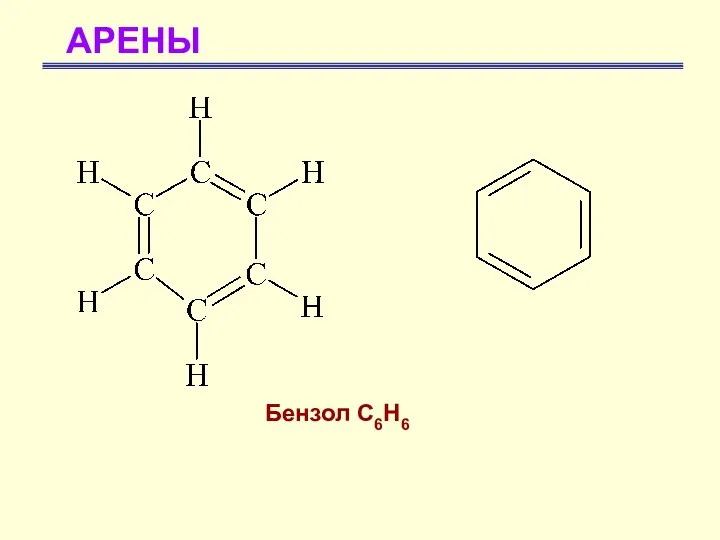
- 3. АРЕНЫ Бензол С6Н6
- 4. АРЕНЫ В современной химической литературе понятие “соединение ароматического ряда” означает сходство химических свойств соединения со свойствами
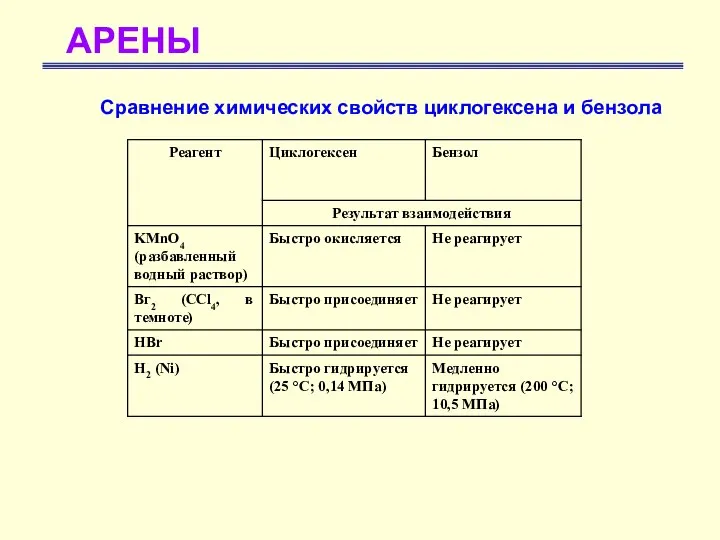
- 5. АРЕНЫ Сравнение химических свойств циклогексена и бензола
- 6. АРЕНЫ Бензол не вступает в реакции присоединения, в которых разрушилась бы π-электронная система бензольного кольца. Такая
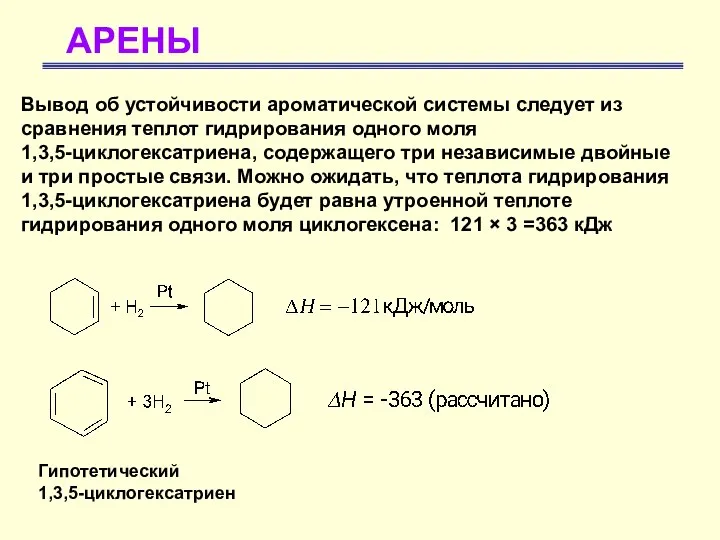
- 7. АРЕНЫ Вывод об устойчивости ароматической системы следует из сравнения теплот гидрирования одного моля 1,3,5-циклогексатриена, содержащего три
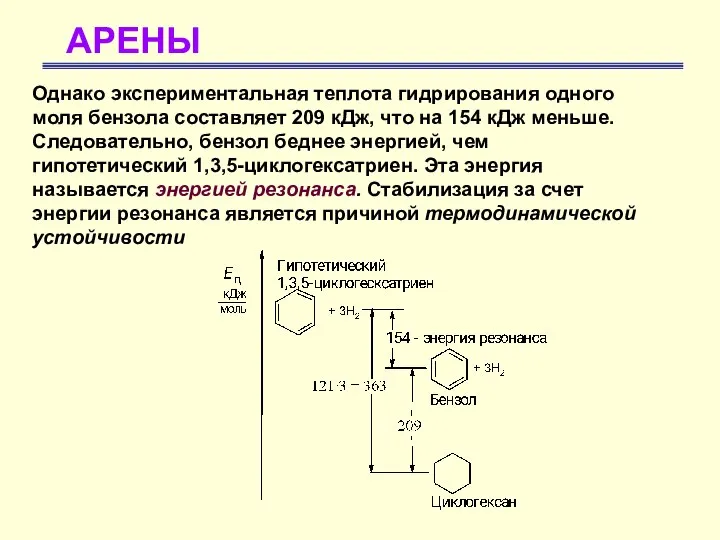
- 8. АРЕНЫ Однако экспериментальная теплота гидрирования одного моля бензола составляет 209 кДж, что на 154 кДж меньше.
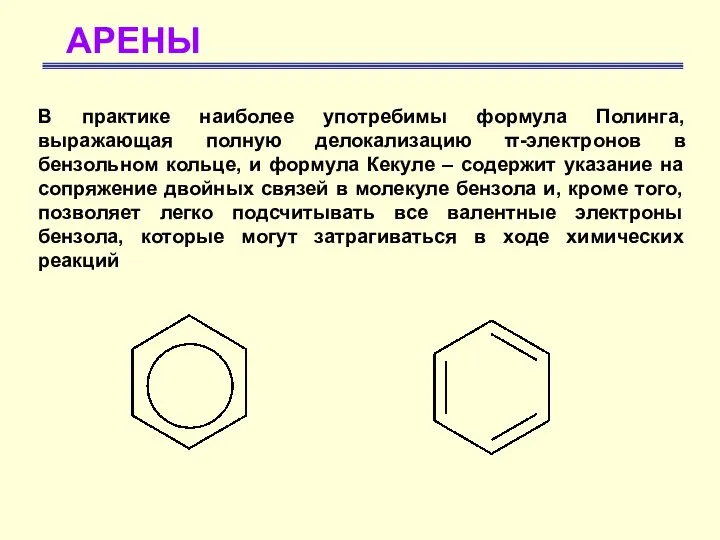
- 9. АРЕНЫ В практике наиболее употребимы формула Полинга, выражающая полную делокализацию π-электронов в бензольном кольце, и формула
- 10. АРЕНЫ Строение молекулы бензола Фридрих Август Кекуле 7 сентября 1829 г. – 13 июля 1896 г.
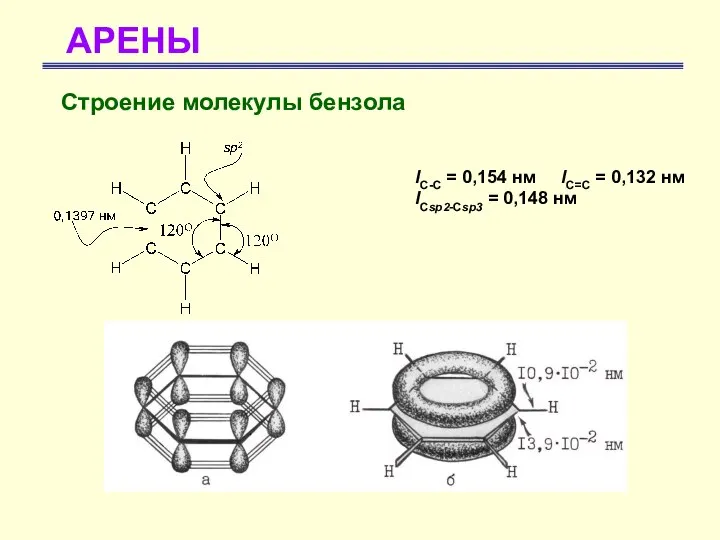
- 11. АРЕНЫ Строение молекулы бензола lС-С = 0,154 нм lС=С = 0,132 нм lCsp2-Csp3 = 0,148 нм
- 12. АРЕНЫ «Ароматичность» – совокупность особых свойств бензола Э.Хюккель вывел правило (1931) Правило Хюккеля: плоские моноциклические соединения,
- 13. АРЕНЫ «Ароматичность» – совокупность особых свойств бензола Эрих Хюккель 1896-1980
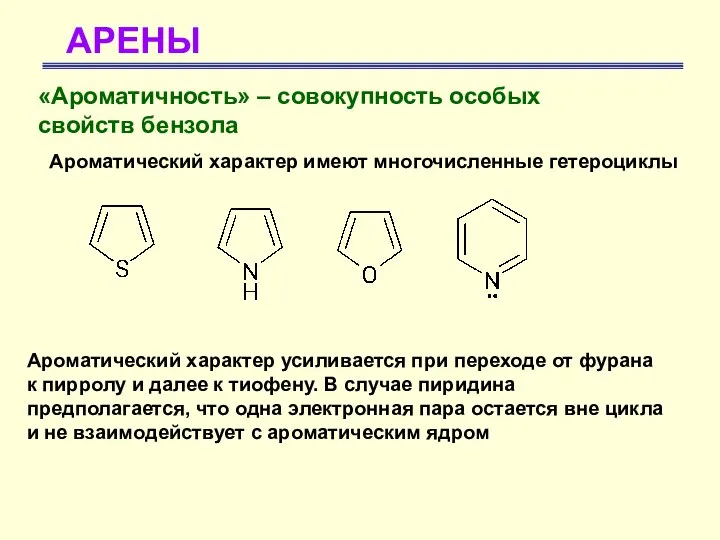
- 14. АРЕНЫ «Ароматичность» – совокупность особых свойств бензола Ароматический характер имеют многочисленные гетероциклы Ароматический характер усиливается при
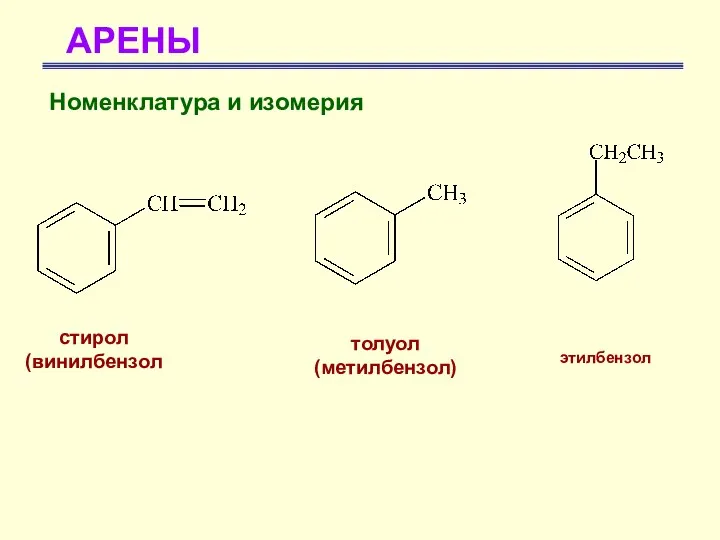
- 15. АРЕНЫ Номенклатура и изомерия стирол (винилбензол толуол (метилбензол) этилбензол
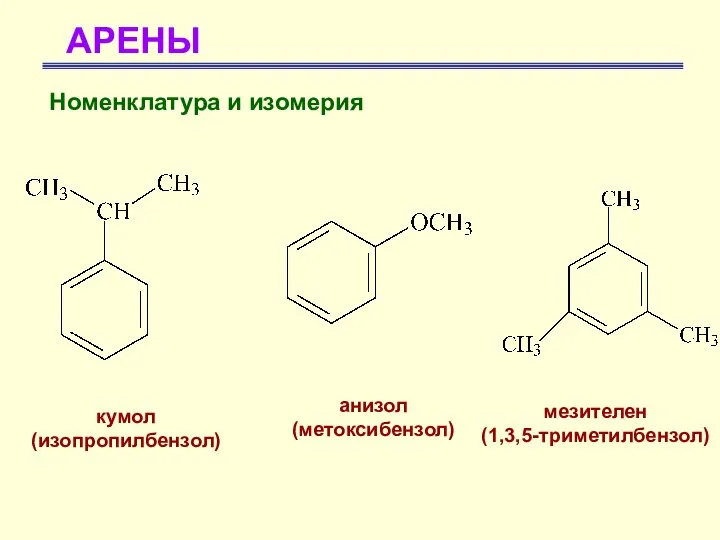
- 16. АРЕНЫ Номенклатура и изомерия кумол (изопропилбензол) анизол (метоксибензол) мезителен (1,3,5-триметилбензол)
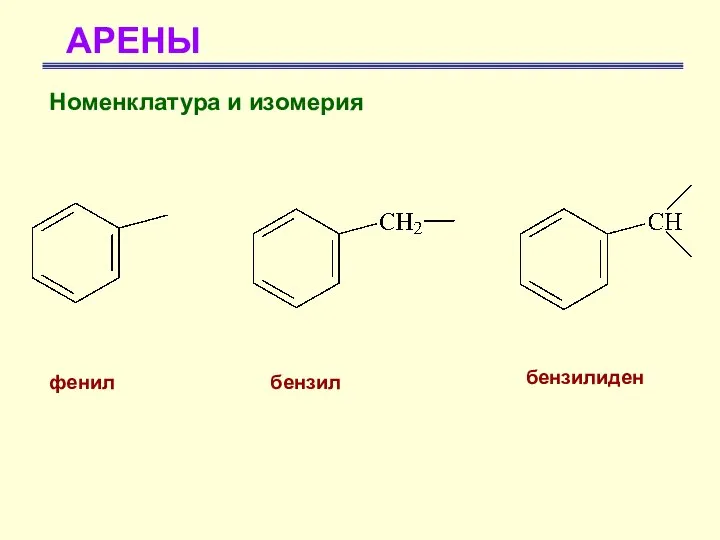
- 17. АРЕНЫ Номенклатура и изомерия фенил бензил бензилиден
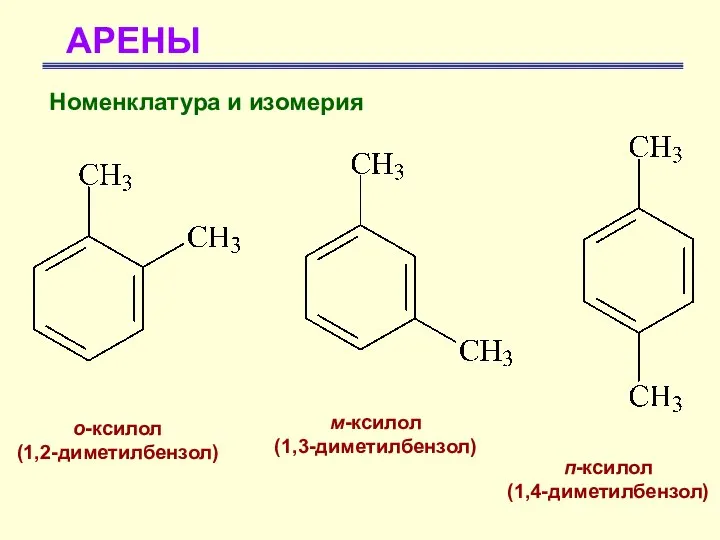
- 18. АРЕНЫ о-ксилол (1,2-диметилбензол) м-ксилол (1,3-диметилбензол) п-ксилол (1,4-диметилбензол) Номенклатура и изомерия
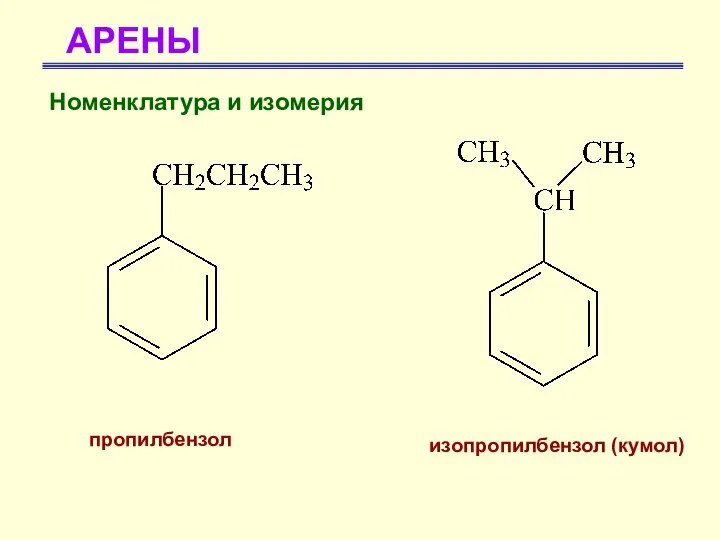
- 19. АРЕНЫ пропилбензол изопропилбензол (кумол) Номенклатура и изомерия
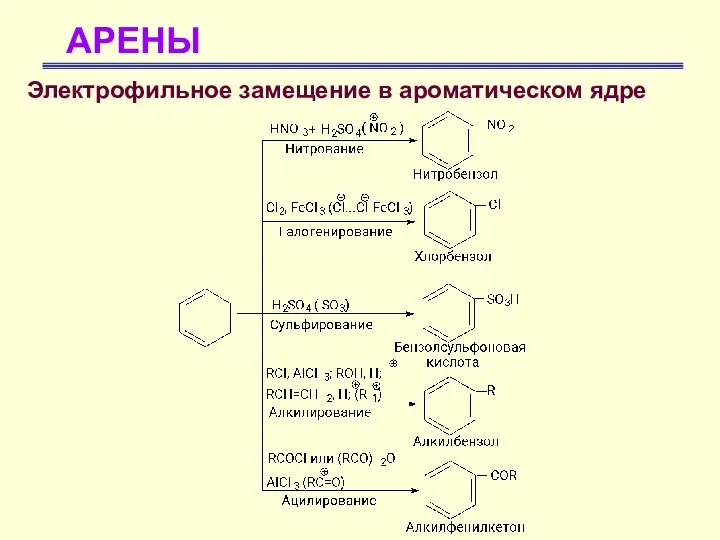
- 20. АРЕНЫ Химические свойства аренов Электрофильное замещение в ароматическом ядре Для бензола характерны реакции замещения атома водорода
- 21. АРЕНЫ Электрофильное замещение в ароматическом ядре
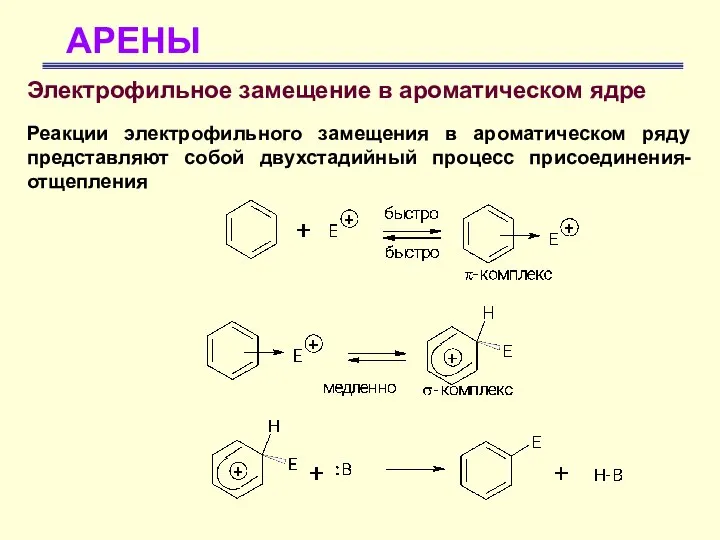
- 22. АРЕНЫ Электрофильное замещение в ароматическом ядре Реакции электрофильного замещения в ароматическом ряду представляют собой двухстадийный процесс
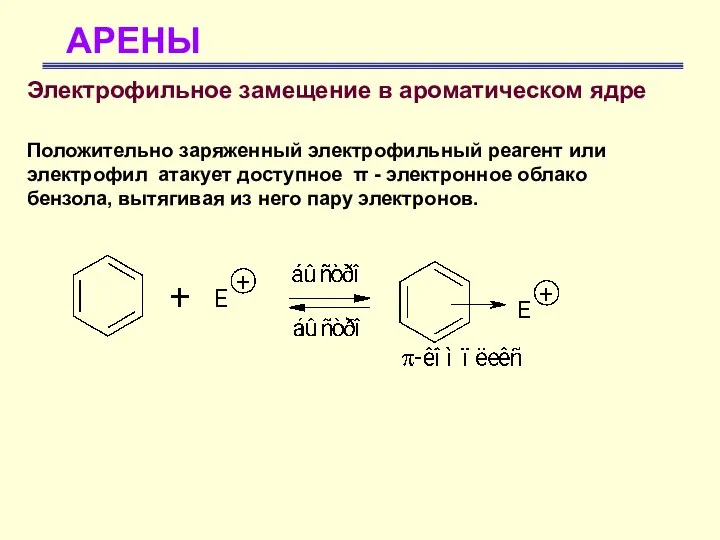
- 23. АРЕНЫ Электрофильное замещение в ароматическом ядре Положительно заряженный электрофильный реагент или электрофил атакует доступное π -
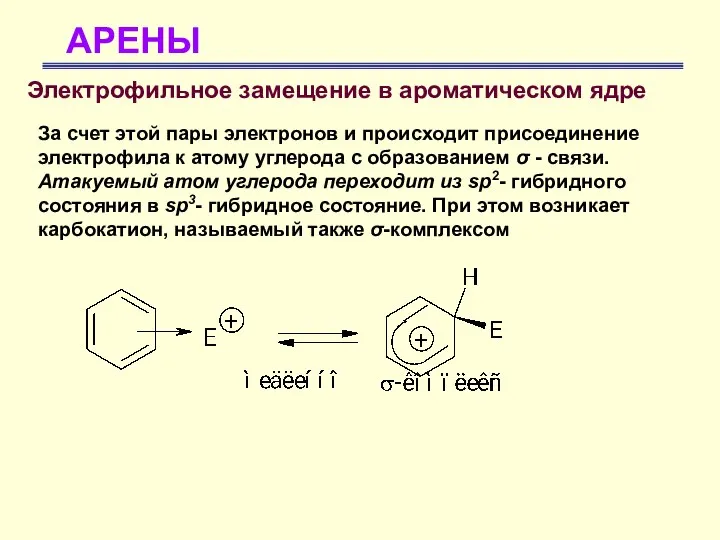
- 24. АРЕНЫ Электрофильное замещение в ароматическом ядре За счет этой пары электронов и происходит присоединение электрофила к
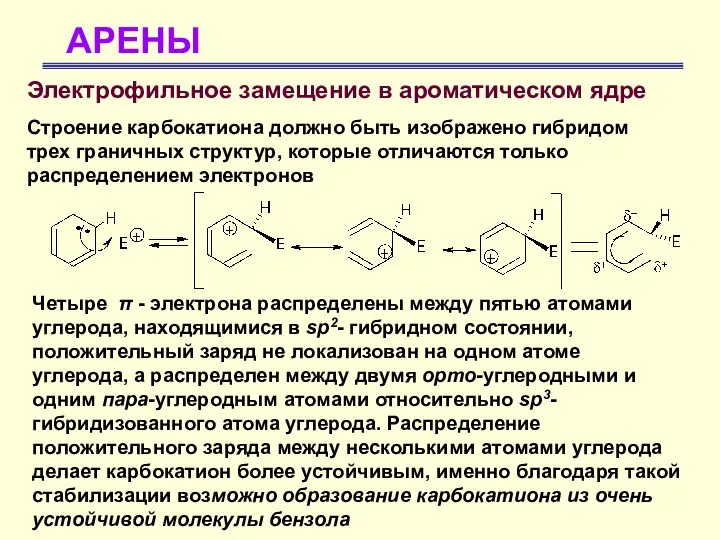
- 25. АРЕНЫ Электрофильное замещение в ароматическом ядре Строение карбокатиона должно быть изображено гибридом трех граничных структур, которые
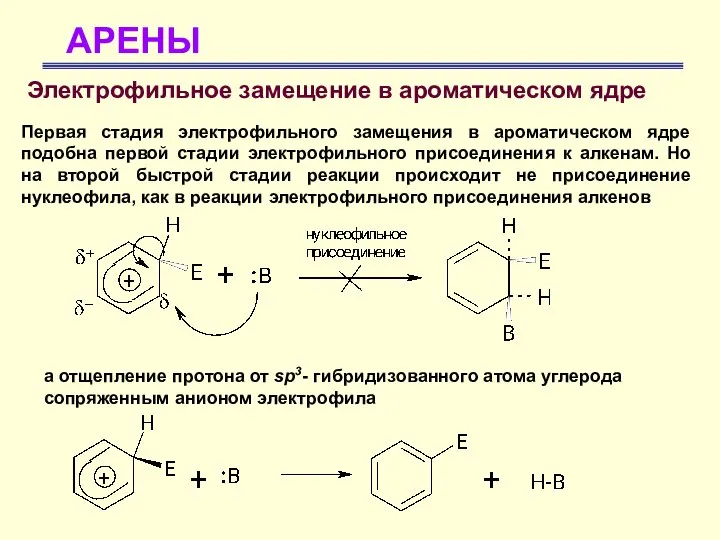
- 26. АРЕНЫ Электрофильное замещение в ароматическом ядре Первая стадия электрофильного замещения в ароматическом ядре подобна первой стадии
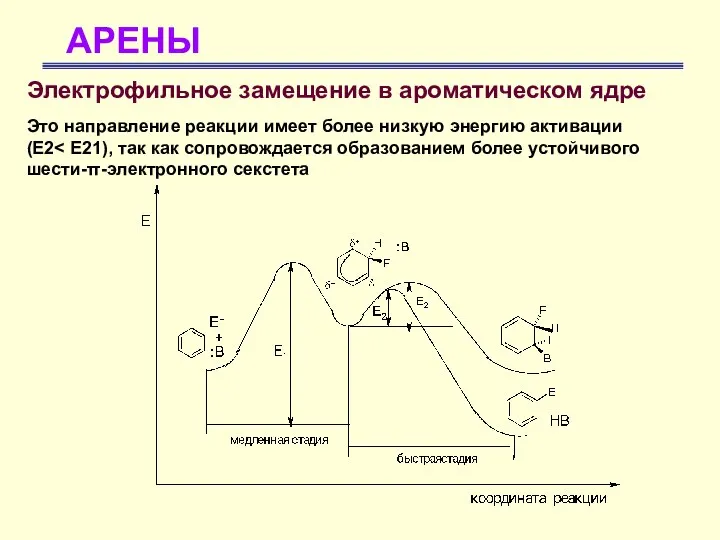
- 27. АРЕНЫ Электрофильное замещение в ароматическом ядре Это направление реакции имеет более низкую энергию активации (Е2
- 28. АРЕНЫ Галогенирование При галогенировании электрофил образуется в реакции галогена с катализатором - кислотой Льюиса (AlCl3, FeCl3
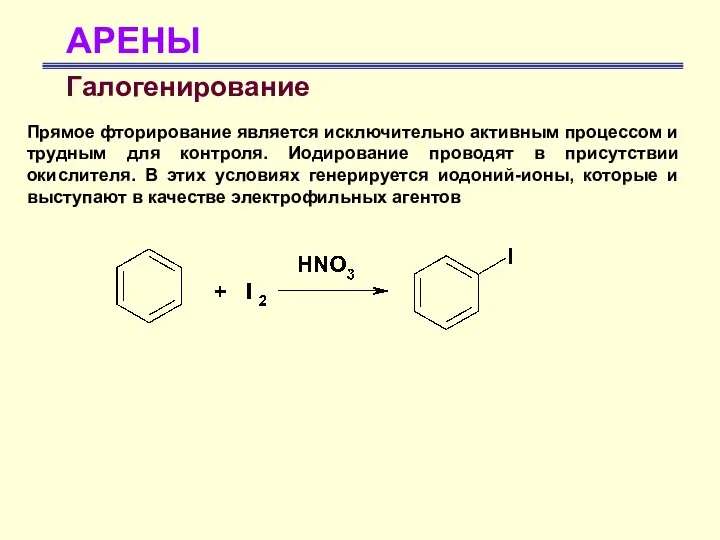
- 29. АРЕНЫ Галогенирование Прямое фторирование является исключительно активным процессом и трудным для контроля. Иодирование проводят в присутствии
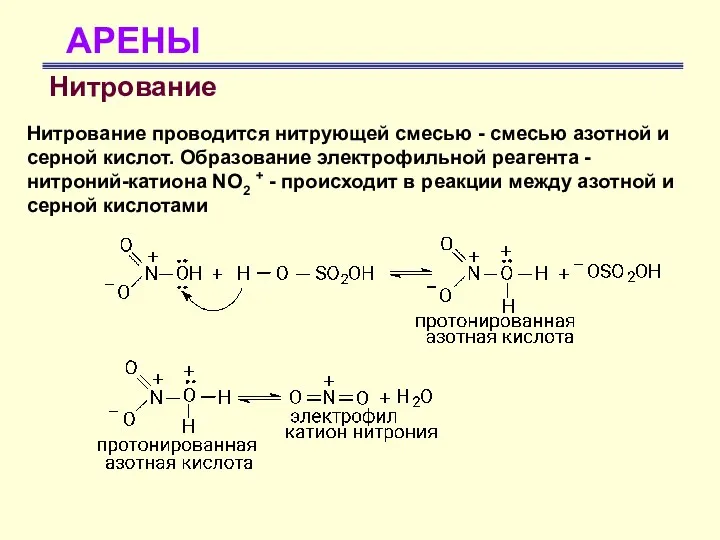
- 30. АРЕНЫ Нитрование Нитрование проводится нитрующей смесью - смесью азотной и серной кислот. Образование электрофильной реагента -
- 31. АРЕНЫ В реакции сульфирования в качестве сульфирующих реагентов чаще всего применяют концентрированную серную кислоту, олеум (дымящая
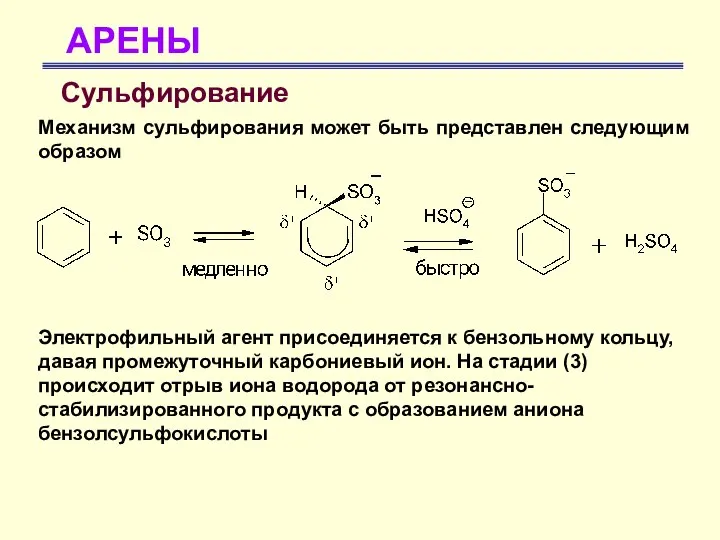
- 32. АРЕНЫ Сульфирование Механизм сульфирования может быть представлен следующим образом Электрофильный агент присоединяется к бензольному кольцу, давая
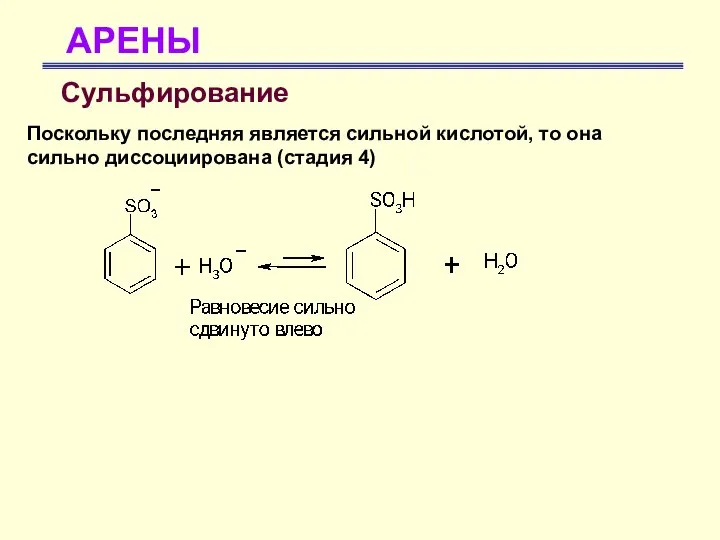
- 33. АРЕНЫ Сульфирование Поскольку последняя является сильной кислотой, то она сильно диссоциирована (стадия 4)
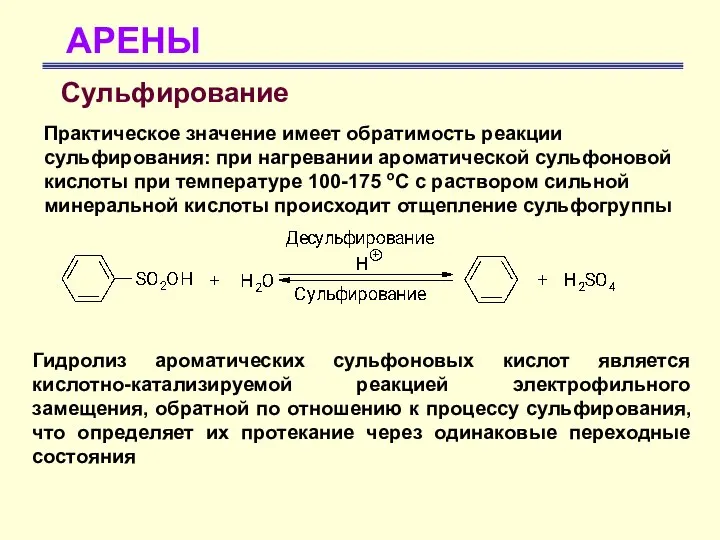
- 34. АРЕНЫ Сульфирование Практическое значение имеет обратимость реакции сульфирования: при нагревании ароматической сульфоновой кислоты при температуре 100-175
- 35. АРЕНЫ Алкилирование Алкилирование — введение алкильной группы в молекулу органического соединения (например, в бензольное кольцо). Реакция
- 36. АРЕНЫ Алкилирование Крафтс (Crafts) Джеймс Мейсон (8.3.1839 — 20.6.1917, США) Фридель (Friedel) Шарль (12.3.1832 — 20.4.1899,
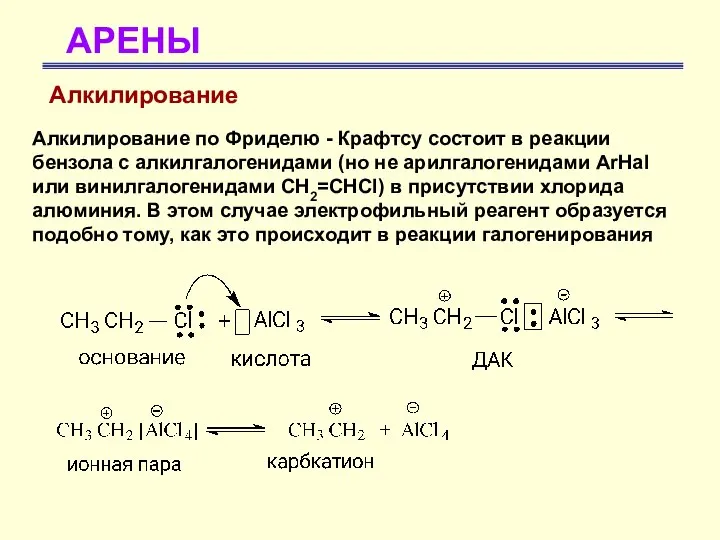
- 37. АРЕНЫ Алкилирование Алкилирование по Фриделю - Крафтсу состоит в реакции бензола с алкилгалогенидами (но не арилгалогенидами
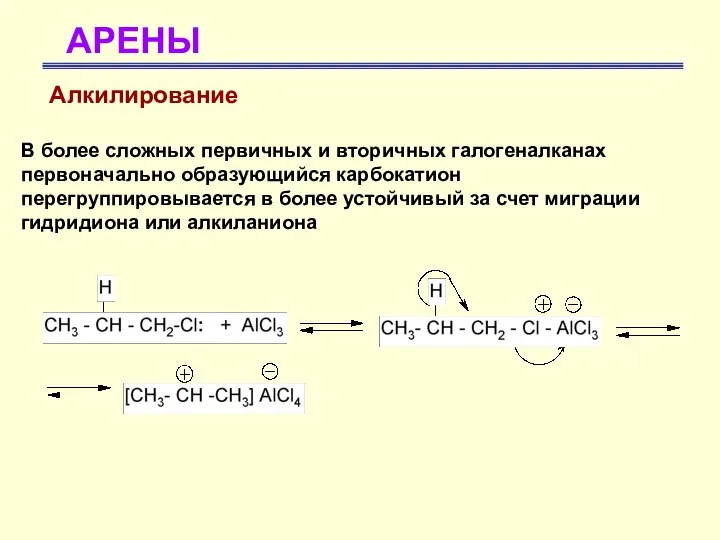
- 38. АРЕНЫ Алкилирование В более сложных первичных и вторичных галогеналканах первоначально образующийся карбокатион перегруппировывается в более устойчивый
- 39. АРЕНЫ Алкилирование При применении алкенов как алкилирующих агентов в качестве катализатора применяют смеси HCl + AlCl3
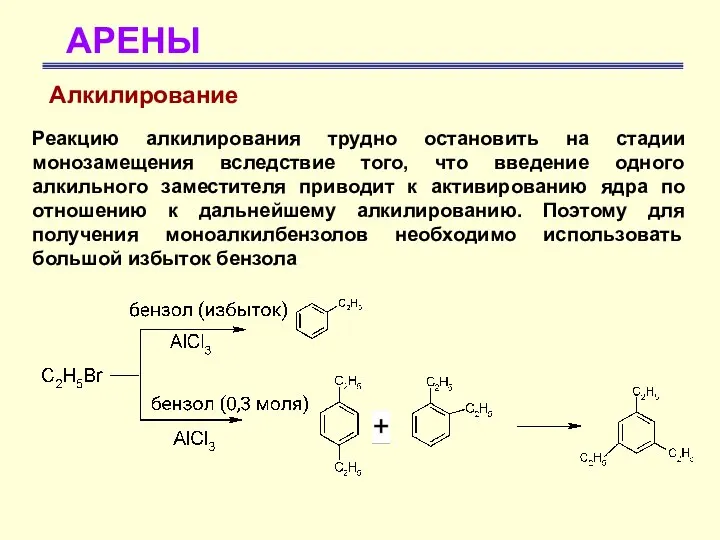
- 40. АРЕНЫ Алкилирование Реакцию алкилирования трудно остановить на стадии монозамещения вследствие того, что введение одного алкильного заместителя
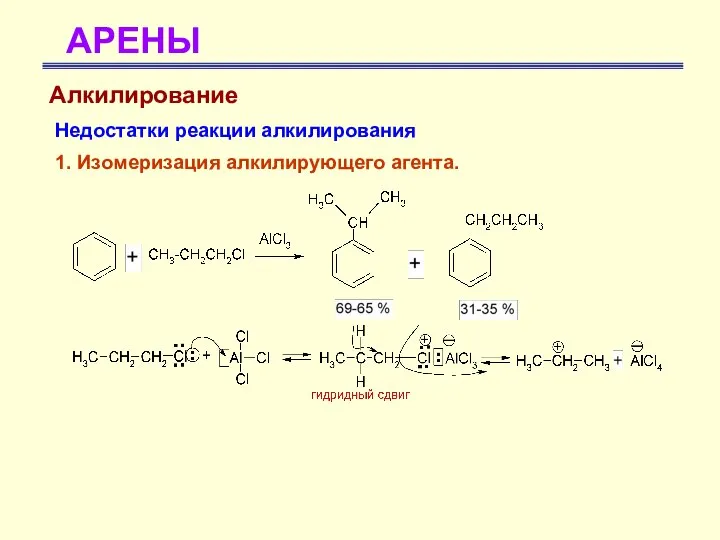
- 41. АРЕНЫ Алкилирование Недостатки реакции алкилирования 1. Изомеризация алкилирующего агента.
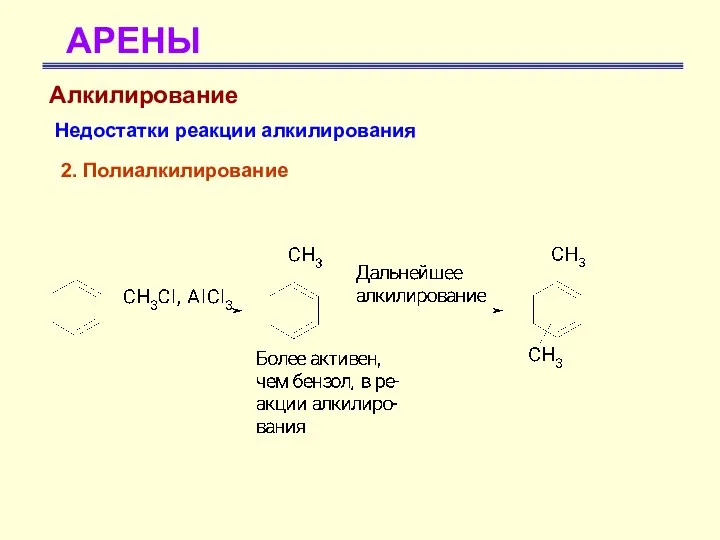
- 42. АРЕНЫ Алкилирование Недостатки реакции алкилирования 2. Полиалкилирование
- 43. АРЕНЫ Алкилирование Недостатки реакции алкилирования 3. Диспропорционирование продуктов Алкилирование – обратимый, термодинамически контролируемый процесс.
- 44. АРЕНЫ Алкилирование Ограничения алкилирования по Фриделю-Крафтсу связанные с группами, которые уже имеются в ароматическом кольце: соединения,
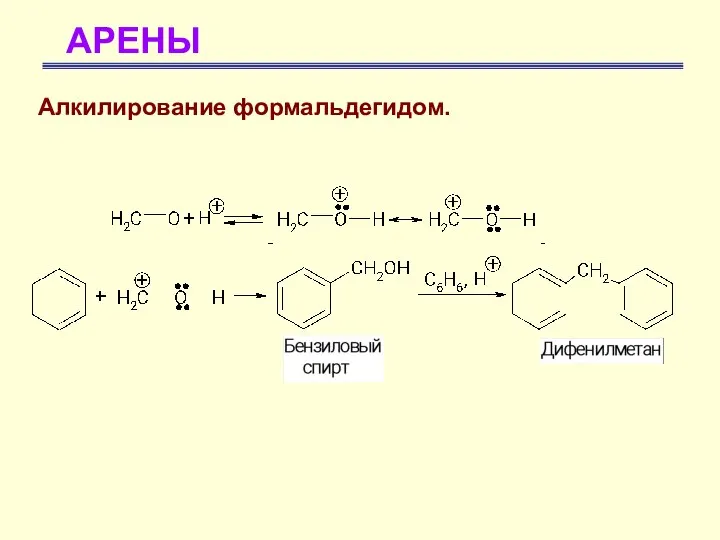
- 45. АРЕНЫ Алкилирование формальдегидом.
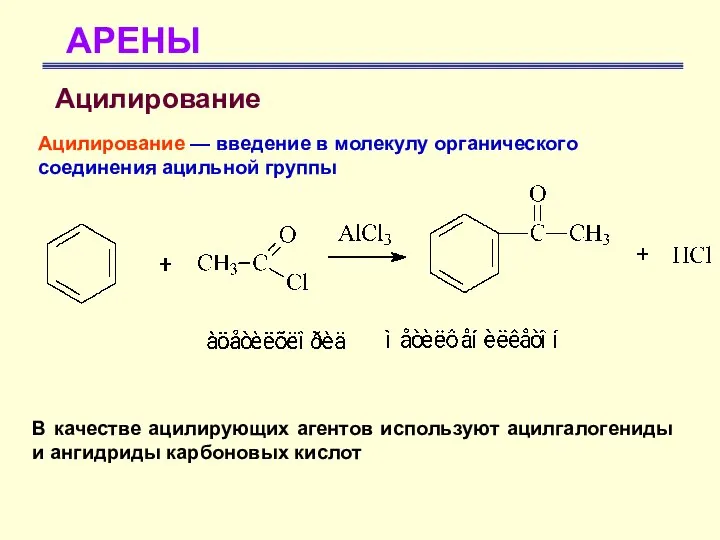
- 46. АРЕНЫ Ацилирование Ацилирование — введение в молекулу органического соединения ацильной группы В качестве ацилирующих агентов используют
- 47. АРЕНЫ Ацилирование В качестве ацилирующих агентов используют ацилгалогениды и ангидриды карбоновых кислот В реакцию ацилирования необходимо
- 48. АРЕНЫ Ацилирование В реакции алкилирования и ацилирования не вступают соединения, содержащие только электроноакцепторные группы (-NO2, -COOH,
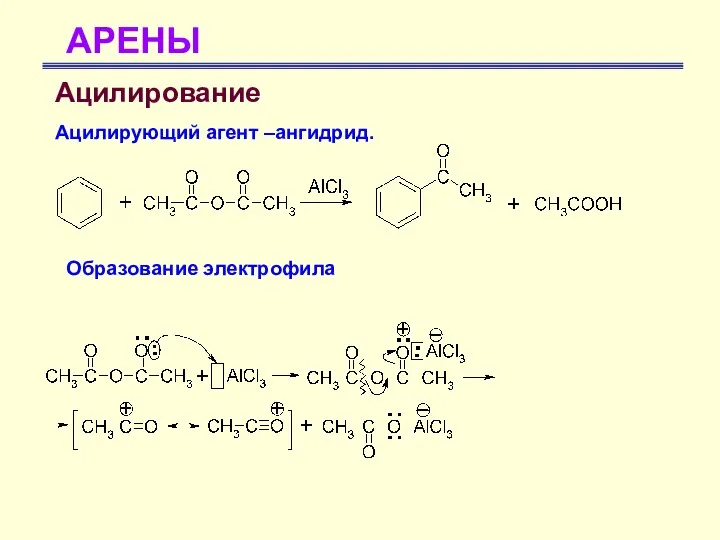
- 49. АРЕНЫ Ацилирование Ацилирующий агент –ангидрид. Образование электрофила
- 50. АРЕНЫ Ацилирование Ацилирующий агент –ангидрид. Образование электрофила
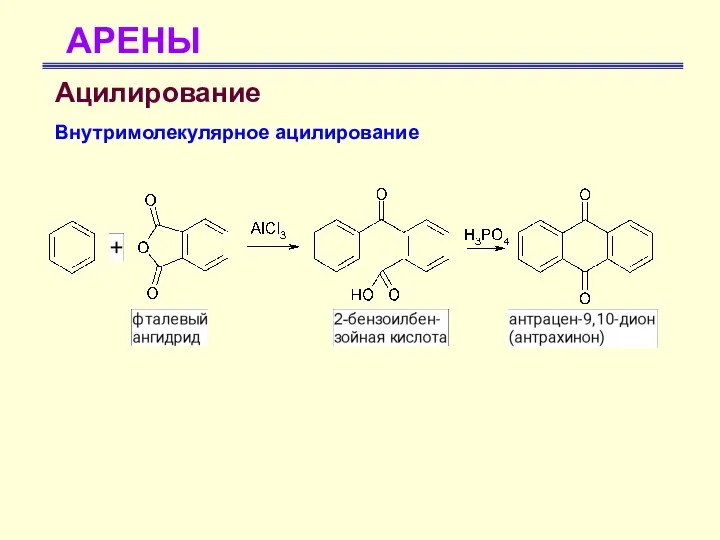
- 51. АРЕНЫ Ацилирование Внутримолекулярное ацилирование
- 52. АРЕНЫ Ацилирование Преимущества ацилирования по Фриделю-Крафтсу: 1. При ацилировании вводится только одна ацильная группа, поскольку ароматические
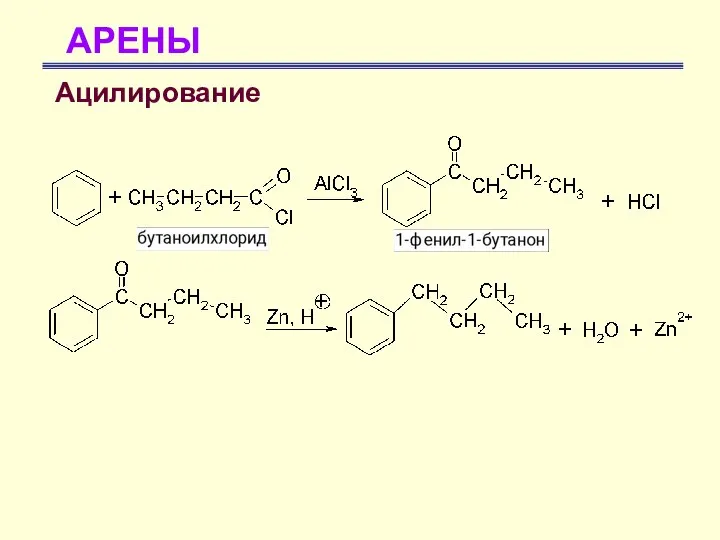
- 53. АРЕНЫ Ацилирование
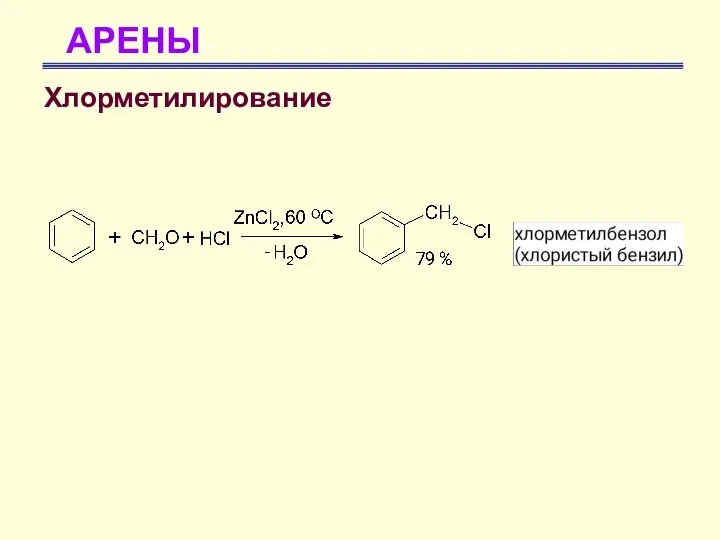
- 54. АРЕНЫ Хлорметилирование
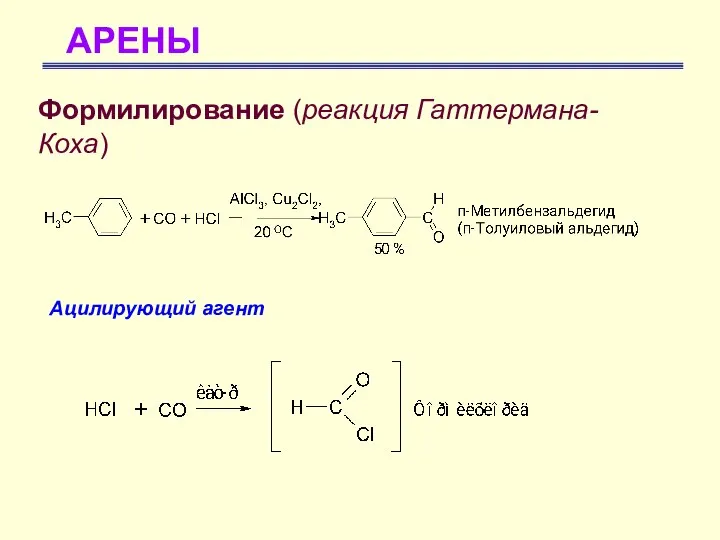
- 55. АРЕНЫ Формилирование (реакция Гаттермана-Коха) Ацилирующий агент
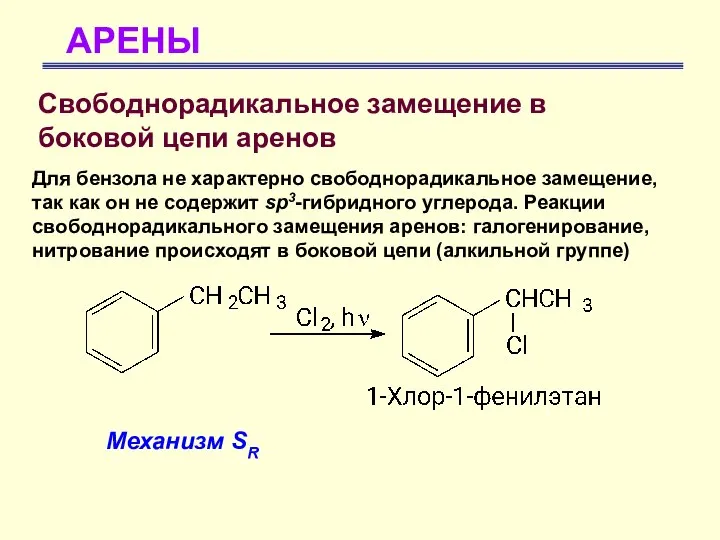
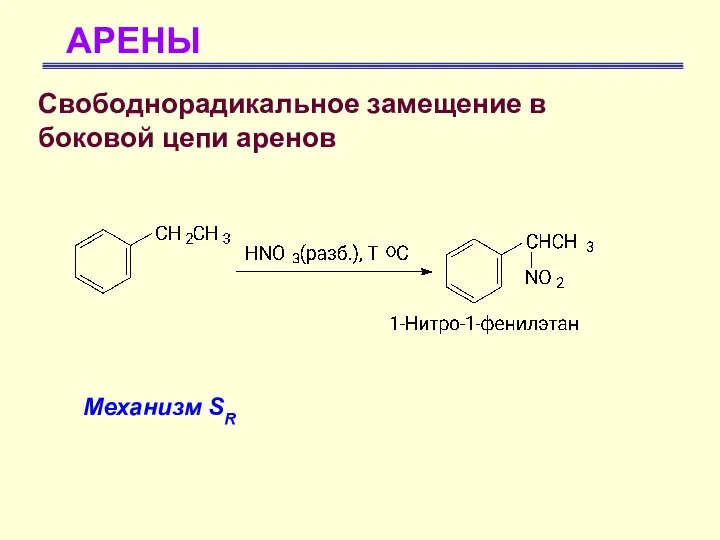
- 56. АРЕНЫ Свободнорадикальное замещение в боковой цепи аренов Для бензола не характерно свободнорадикальное замещение, так как он
- 57. АРЕНЫ Свободнорадикальное замещение в боковой цепи аренов Механизм SR
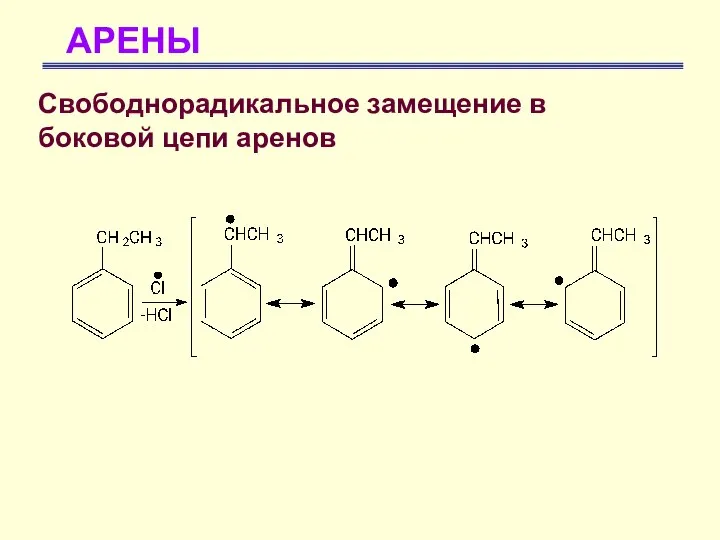
- 58. АРЕНЫ Свободнорадикальное замещение в боковой цепи аренов Избирательность в этих реакциях объясняется высокой устойчивостью соответствующих алкилароматических
- 59. АРЕНЫ Свободнорадикальное замещение в боковой цепи аренов
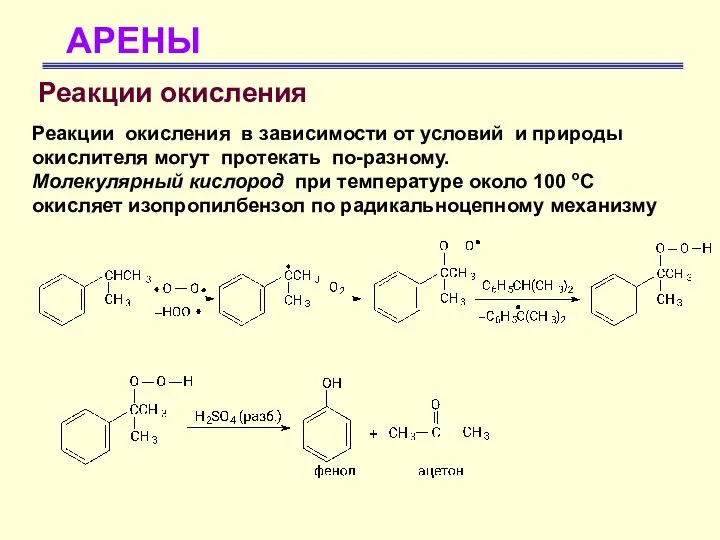
- 60. АРЕНЫ Реакции окисления Реакции окисления в зависимости от условий и природы окислителя могут протекать по-разному. Молекулярный
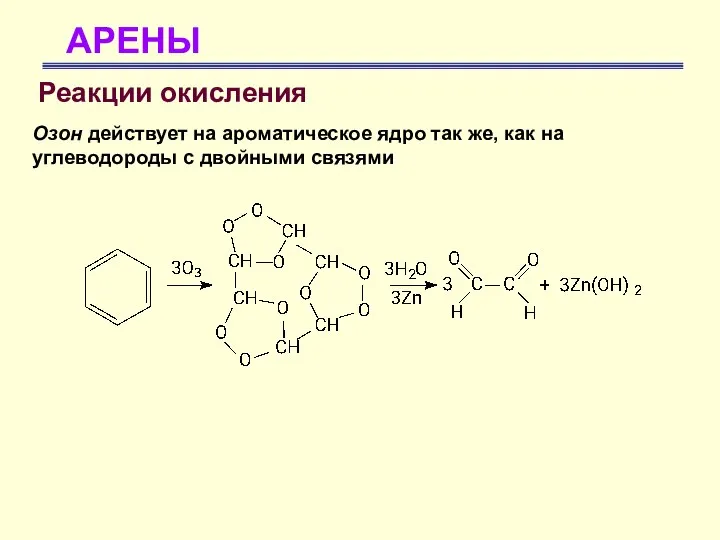
- 61. АРЕНЫ Реакции окисления Озон действует на ароматическое ядро так же, как на углеводороды с двойными связями
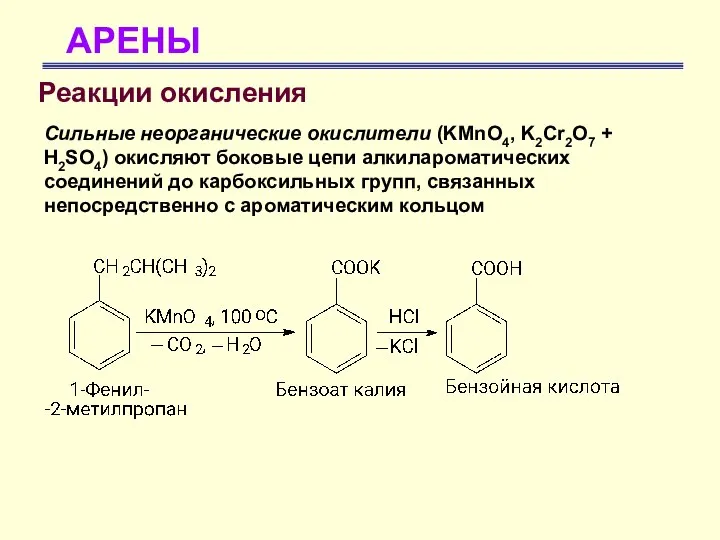
- 62. АРЕНЫ Реакции окисления Сильные неорганические окислители (KMnO4, K2Cr2O7 + H2SO4) окисляют боковые цепи алкилароматических соединений до
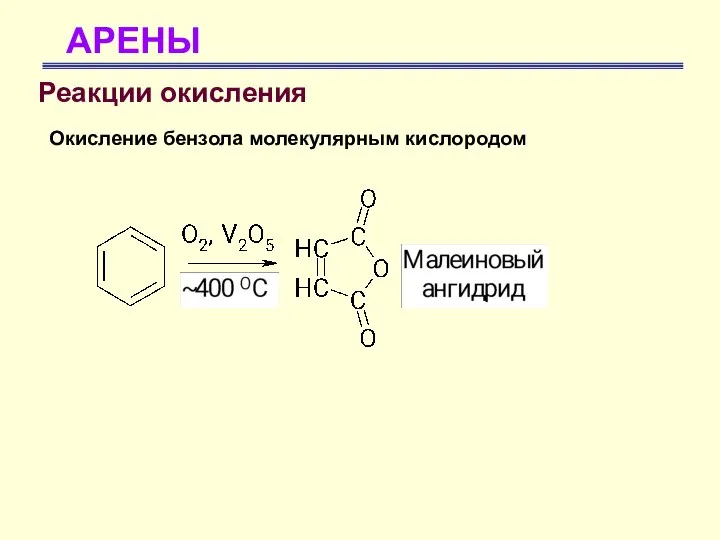
- 63. АРЕНЫ Реакции окисления Окисление бензола молекулярным кислородом
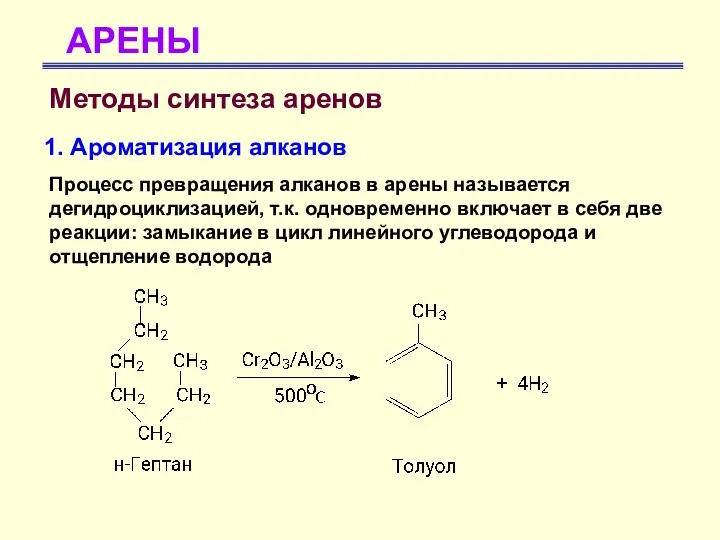
- 64. АРЕНЫ Методы синтеза аренов 1. Ароматизация алканов Процесс превращения алканов в арены называется дегидроциклизацией, т.к. одновременно
- 65. АРЕНЫ Методы синтеза аренов 2. Реакция Вюрца – Фиттига При взаимодействии галогенаренов с галогеналканами (предпочтительно использовать
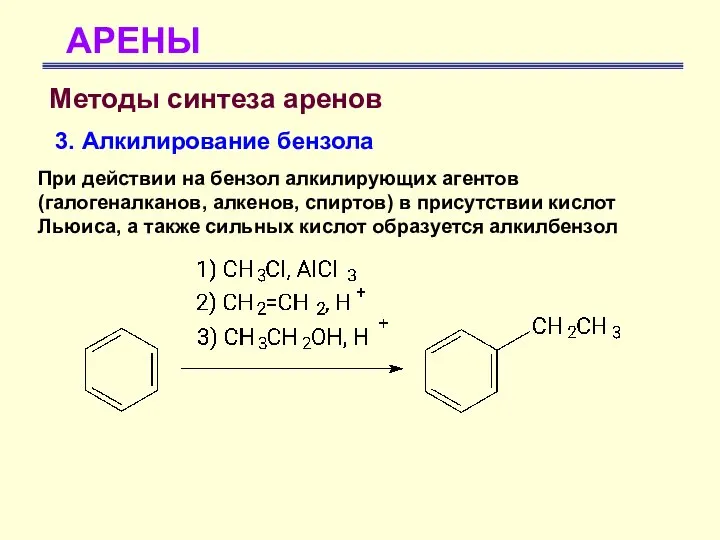
- 66. АРЕНЫ Методы синтеза аренов 3. Алкилирование бензола При действии на бензол алкилирующих агентов (галогеналканов, алкенов, спиртов)
- 68. Скачать презентацию




















 Презентация Основы таможенного дела
Презентация Основы таможенного дела Рекомендации по монтажу преобразователей частоты для повышения их ЭМС
Рекомендации по монтажу преобразователей частоты для повышения их ЭМС Радиобиология
Радиобиология  Потоки и файлы
Потоки и файлы Мораль. Религия
Мораль. Религия Сенатская Площадь
Сенатская Площадь  «Вредные советы Оратору». Юмористически-познавательная работа для всех кто выступает с презентациями
«Вредные советы Оратору». Юмористически-познавательная работа для всех кто выступает с презентациями Основы объектно-ориентированного программирования
Основы объектно-ориентированного программирования Древняя Керкинитида. Средневековый Гезлёв. Современная Евпатория
Древняя Керкинитида. Средневековый Гезлёв. Современная Евпатория Конструкционные и функциональные волокнистые композиты. Неорганические матрицы
Конструкционные и функциональные волокнистые композиты. Неорганические матрицы Дорожный бетон
Дорожный бетон Число. Имя числительное - презентация по Алгебре_
Число. Имя числительное - презентация по Алгебре_ Франсиско Гойя(1746-1828гг.)
Франсиско Гойя(1746-1828гг.) Метрологическое обеспечение строительства. (Лекция 1)
Метрологическое обеспечение строительства. (Лекция 1) Цифровой логический уровень
Цифровой логический уровень  В музеях искусства. Пейзаж. 3 класс
В музеях искусства. Пейзаж. 3 класс Эскизы декорации
Эскизы декорации Русское деревянное культовое зодчество
Русское деревянное культовое зодчество Мейрамханада қызметкерлерді басқару
Мейрамханада қызметкерлерді басқару Тема 11. Особенности экономической политики государства Вопросы: 1. Экономическая политика: принципы, цели, инструменты 2. Финан
Тема 11. Особенности экономической политики государства Вопросы: 1. Экономическая политика: принципы, цели, инструменты 2. Финан Население и трудовые ресурсы
Население и трудовые ресурсы Закон об энергосбережении и о повышении энергетической эффективности и о внесении изменений в отдельные законодательные акты
Закон об энергосбережении и о повышении энергетической эффективности и о внесении изменений в отдельные законодательные акты Образование поверхностей и решение задач на пересечение поверхностей. (Лекция 4.2)
Образование поверхностей и решение задач на пересечение поверхностей. (Лекция 4.2) Пауки не являются насекомыми, а принадлежат к классу паукообразных. В отличие от насекомых, у них восемь ног. - презентация
Пауки не являются насекомыми, а принадлежат к классу паукообразных. В отличие от насекомых, у них восемь ног. - презентация Устройство и эксплуатация систем передачи с частотным разделением каналов. Аппаратура каналообразования П-303-ОБ. (Тема 3.2)
Устройство и эксплуатация систем передачи с частотным разделением каналов. Аппаратура каналообразования П-303-ОБ. (Тема 3.2) Франсуа Виет
Франсуа Виет Инженерно-геодезические изыскания
Инженерно-геодезические изыскания Плоскостные элементы благоустройства территории. Дорожки и площадки
Плоскостные элементы благоустройства территории. Дорожки и площадки