Содержание
- 2. Введение
- 3. I Прибайкальская межрегиональная научно-практическая конференция (2006 год)
- 4. Кроветворение Кроветворение (синоним гематопоэз) — процесс, заключающийся в серии клеточных дифференцировок, в результате которых образуются зрелые
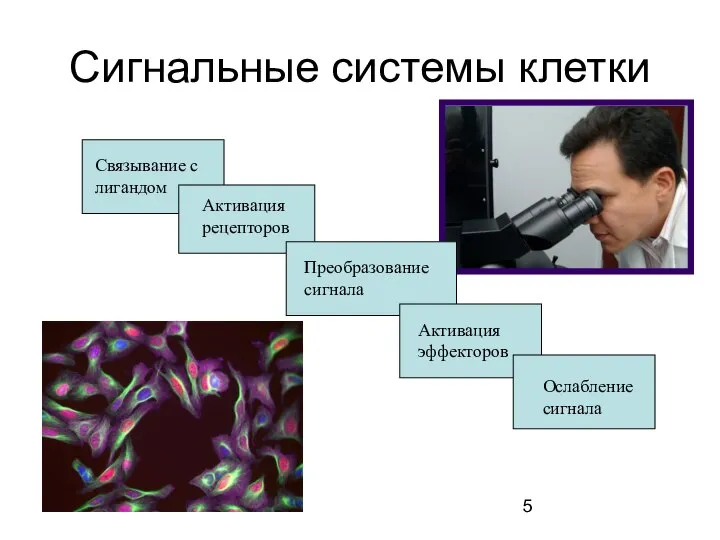
- 5. Сигнальные системы клетки
- 6. Биология сигнальных систем клетки Кроветворные клетки имеют рецепторы к экзогенным сигнальным молекулам: факторам роста, цитокинам, гормонам(стероидным
- 7. Киназы и фосфатазы Фосфорилирование и дефосфорилирование - основные механизмы внутриклеточной передачи сигнала В этих профессах участвуют
- 8. Рецепторы факторов роста Рецепторы факторов роста обычно стимулируют клеточный рост, однако при определенных условиях они могут
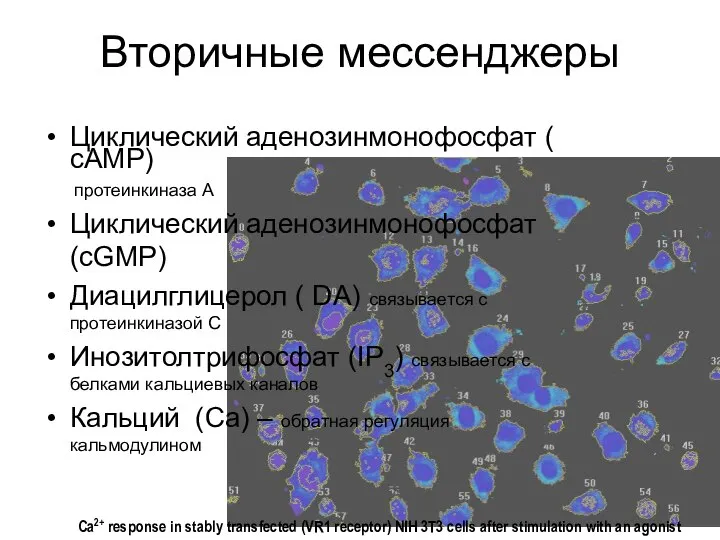
- 9. Вторичные мессенджеры Циклический аденозинмонофосфат ( cAMP) протеинкиназа А Циклический аденозинмонофосфат (cGMP) Диацилглицерол ( DA) связывается с
- 10. Способы доставки сигнальных молекул к клеткам Эндокринный механизм Паракринный механизм – клетка секретирует сигнальные молекулы и
- 11. Рецепторы клеток Группа 1 Семейство липофильных рецепторов: Стероиды: ГК, МК, половые стероиды Тиреоидные гормоны, тироксин Ретиноиды,
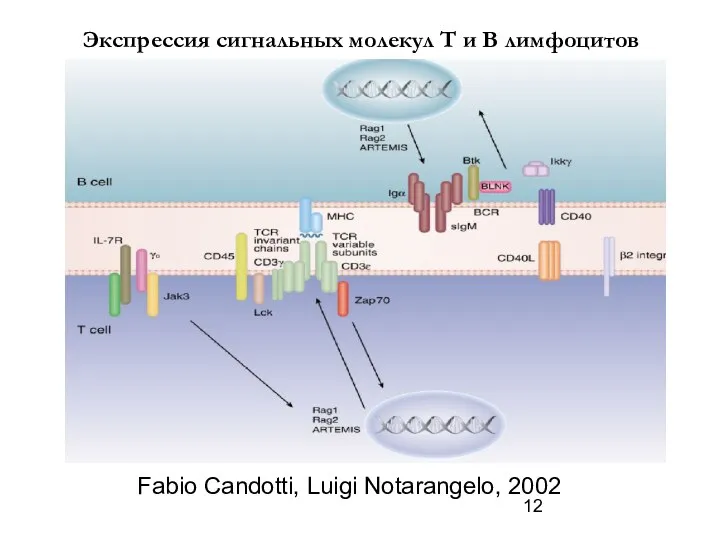
- 12. Fabio Candotti, Luigi Notarangelo, 2002 Экспрессия сигнальных молекул Т и В лимфоцитов
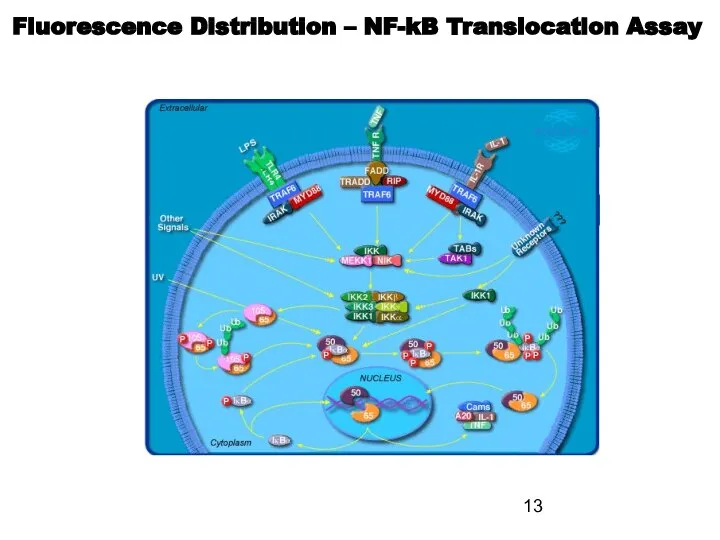
- 13. Fluorescence Distribution – NF-kB Translocation Assay
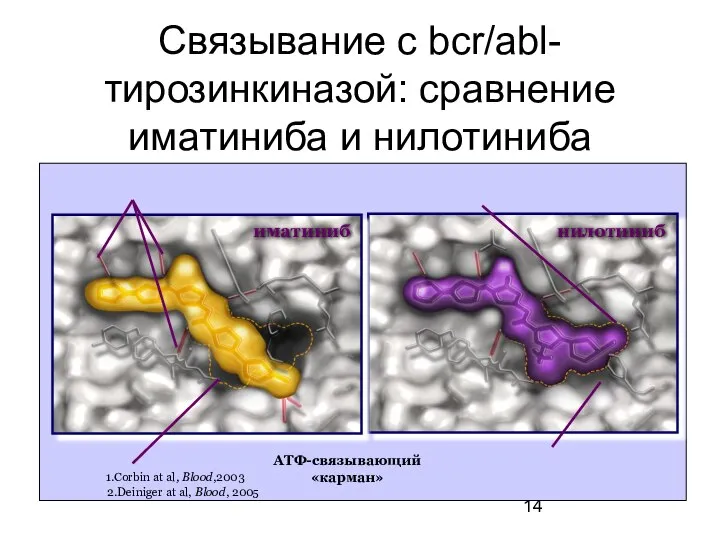
- 14. Связывание с bcr/abl-тирозинкиназой: сравнение иматиниба и нилотиниба
- 15. Внутриклеточные сигнальные пути Кроме активации ras-путиКроме активации ras-пути , в клетках существуют еще по крайней мере
- 16. Свойства факторов роста Факторами роста называют группу белковых молекул, индуцирующих синтез ДНКФакторами роста называют группу белковых
- 17. К Л Е Т О Ч Ы Й Ц И К Л Основные термины: Интерфаза Митотический
- 18. Трубочки, колечки и висюльки Первым, как отмечают историки, клетку увидел Роберт Гук в 1663 году. Но
- 19. Митотический цикл Митотический цикл - совокупность последовательных и взаимосвязанных процессов в период подготовки клетки к делению,
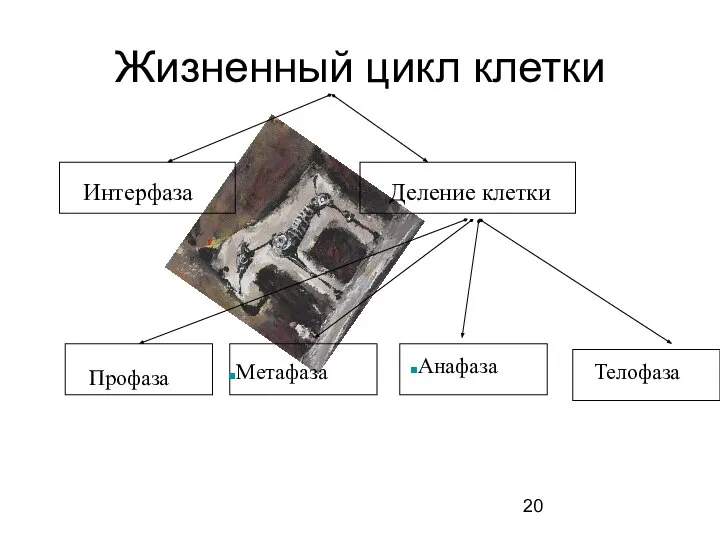
- 20. Жизненный цикл клетки Профаза Метафаза Анафаза Телофаза Деление клетки Интерфаза
- 22. Митотический цикл Митотический цикл = фаза М – это цикл деления, который длится обычно 30-60 минут
- 24. G 0 Наступает за фазой G1 Клетка экспрессирует белки, которые используются не для клеточного деления Гены,
- 25. Когда нормальные клетки прекращают делиться? Гены, включающие пролиферацию выключаются, если клетка получает сигнал, что все точки
- 26. Интегрины Интегрины-поверхностные рецепторы клетки, переносящие сигналы от внеклеточного матрикса к цитоскелету. «включают» рост, метастазирование, опухолевых клеток,
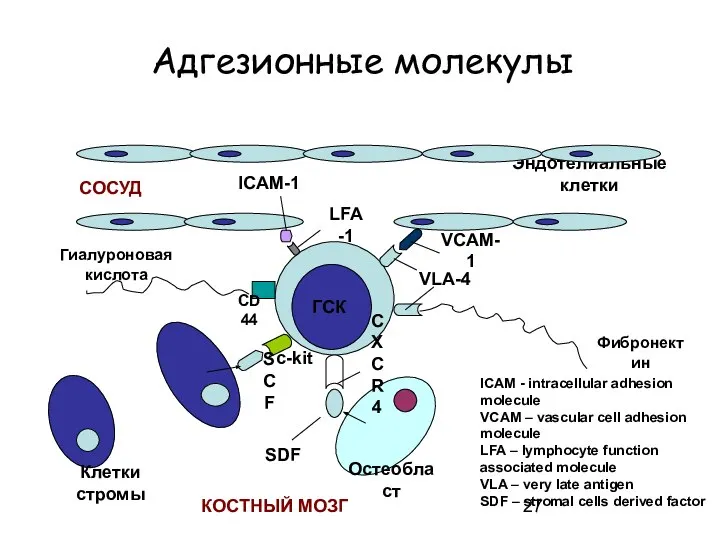
- 27. Адгезионные молекулы c-kit Клетки стромы Эндотелиальные клетки ГСК Гиалуроновая кислота CD44 Фибронектин VLA-4 VCAM-1 LFA-1 ICAM-1
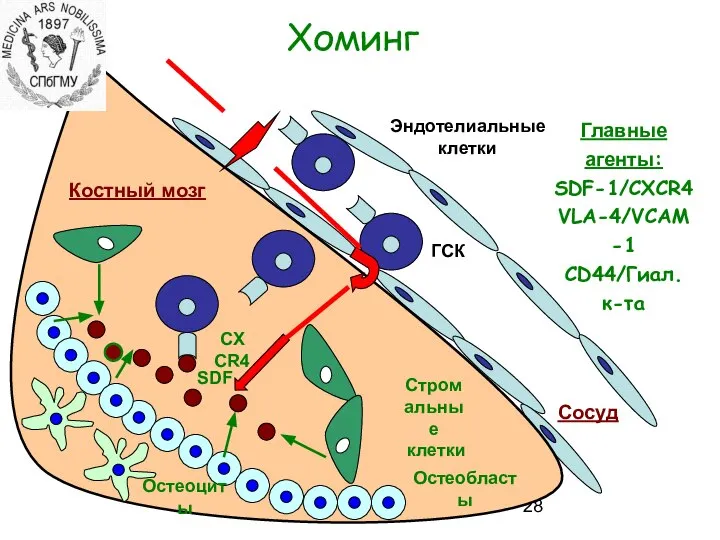
- 28. Хоминг Костный мозг Сосуд Остеобласты SDF Остеоциты Стромальные клетки Эндотелиальные клетки ГСК CXCR4 Главные агенты: SDF-1/CXCR4
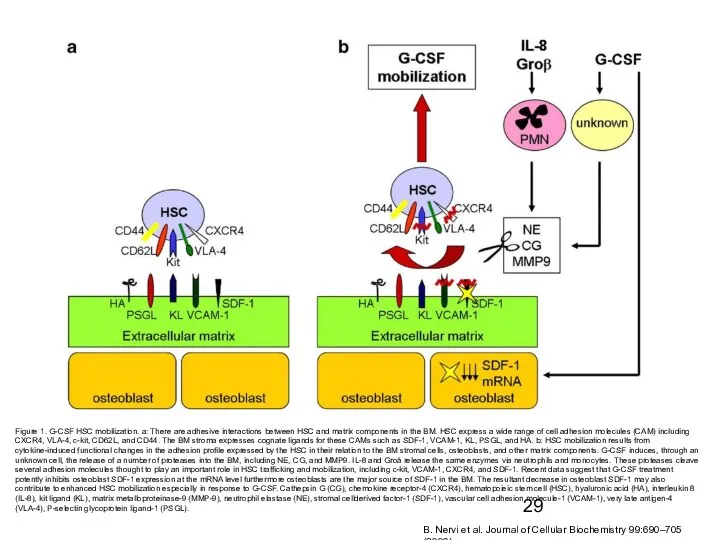
- 29. Figure 1. G-CSF HSC mobilization. a: There are adhesive interactions between HSC and matrix components in
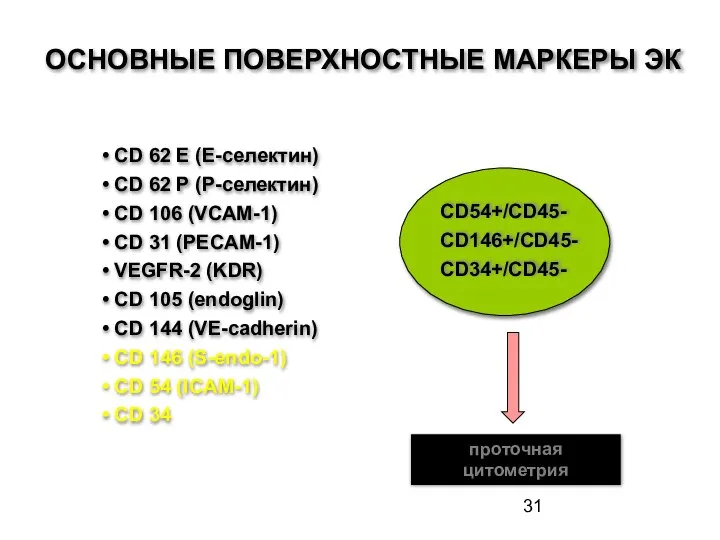
- 31. ОСНОВНЫЕ ПОВЕРХНОСТНЫЕ МАРКЕРЫ ЭК CD 62 E (E-селектин) CD 62 P (Р-селектин) CD 106 (VCAM-1) CD
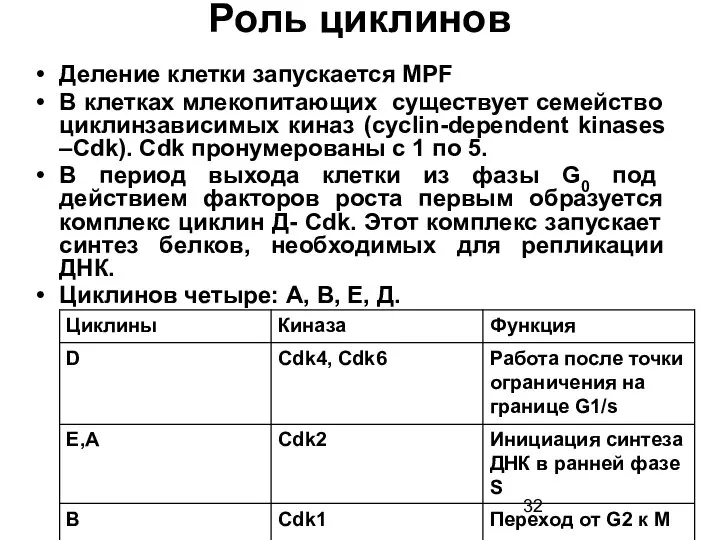
- 32. Роль циклинов Деление клетки запускается MPF В клетках млекопитающих существует семейство циклинзависимых киназ (cyclin-dependent kinases –Cdk).
- 33. Циклин В Циклин В – контролирует вхождение клеток в митоз. Состоит из 2 субьединиц: - киназного
- 34. MPF (циклин В) Разрушение MPF циклином Д вызывает выход из митоза. MPF участвует в начальных этапах
- 35. Митоз Сопровождается: Компактизацией, конденсацией хромосом, в 10 000 раз в нуклеосомы в середине G2 фазы Растворением
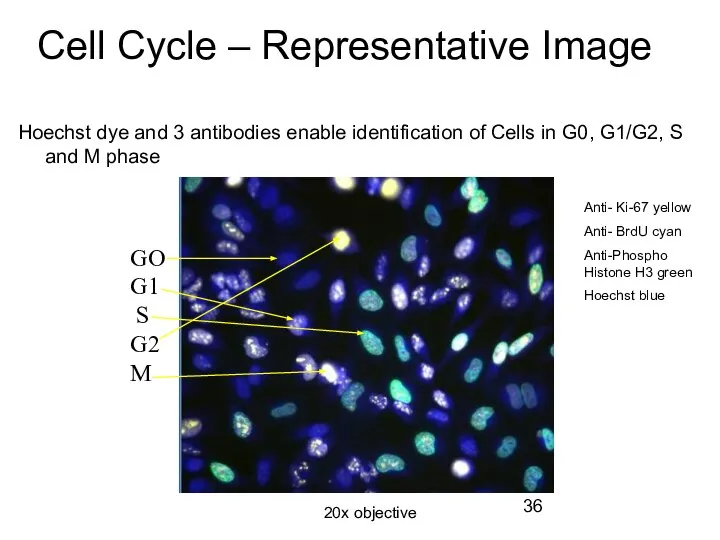
- 36. Cell Cycle – Representative Image Hoechst dye and 3 antibodies enable identification of Cells in G0,
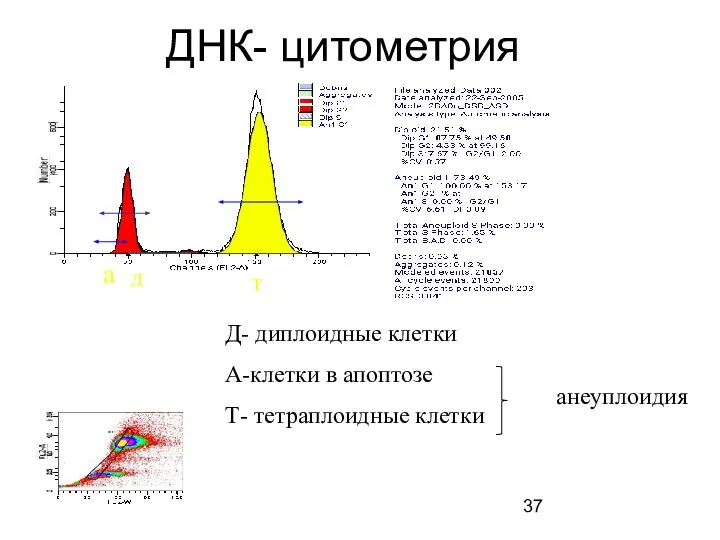
- 37. ДНК- цитометрия а д т Д- диплоидные клетки А-клетки в апоптозе Т- тетраплоидные клетки анеуплоидия
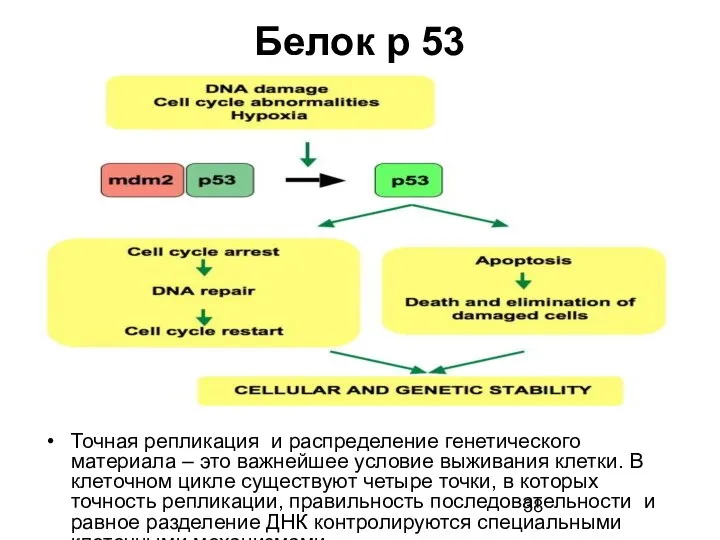
- 38. Белок р 53 Точная репликация и распределение генетического материала – это важнейшее условие выживания клетки. В
- 39. Делеция 17p перед началом терапии Прогрессия на фоне лечения или рецидив в течение 12 месяцев от
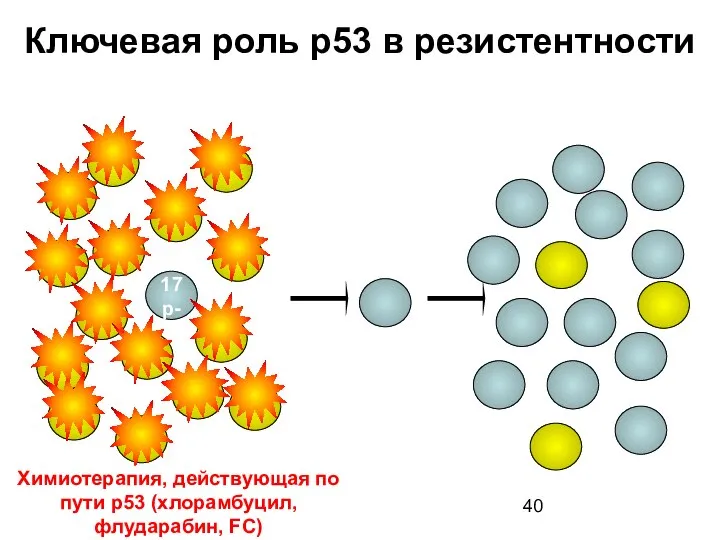
- 40. N Ключевая роль p53 в резистентности 17p- До лечения
- 41. Делеция 17p Прогрессия на фоне лечения или рецидив в течение 12 месяцев от начала терапии Преимущественное
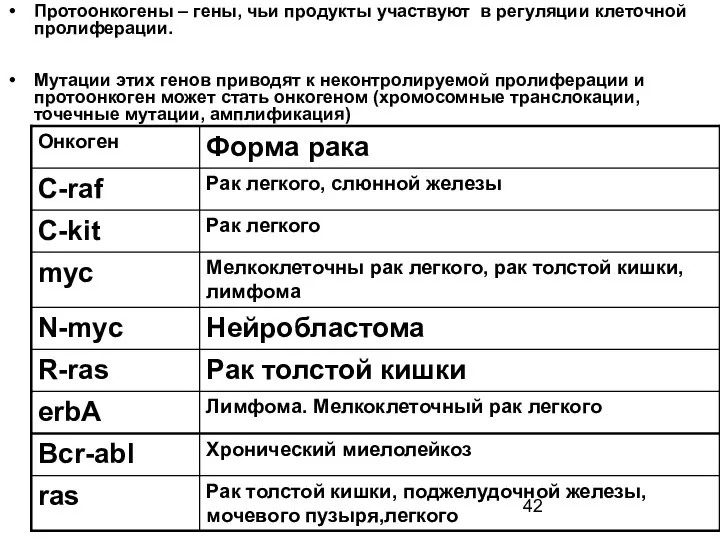
- 42. Протоонкогены – гены, чьи продукты участвуют в регуляции клеточной пролиферации. Мутации этих генов приводят к неконтролируемой
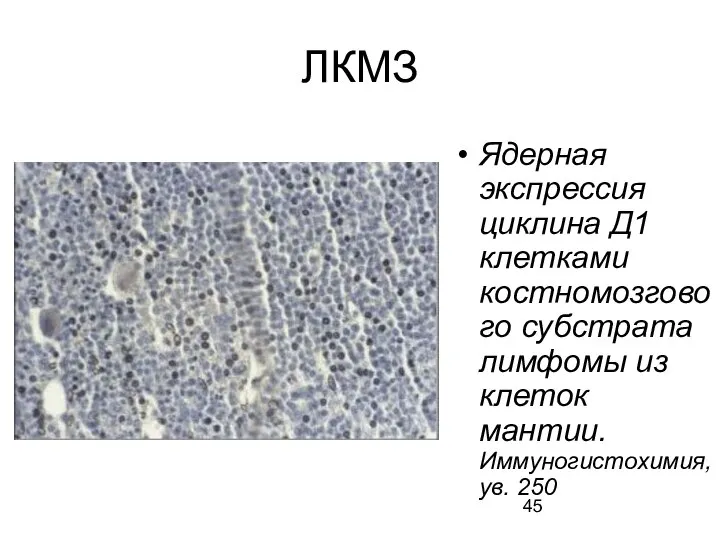
- 43. ЛКМЗ В-клеточная опухоль, характеризующаяся транслокацией или амплификацией локуса 11q13, приводящими к гиперэкспрессии ядерного белка циклина D1
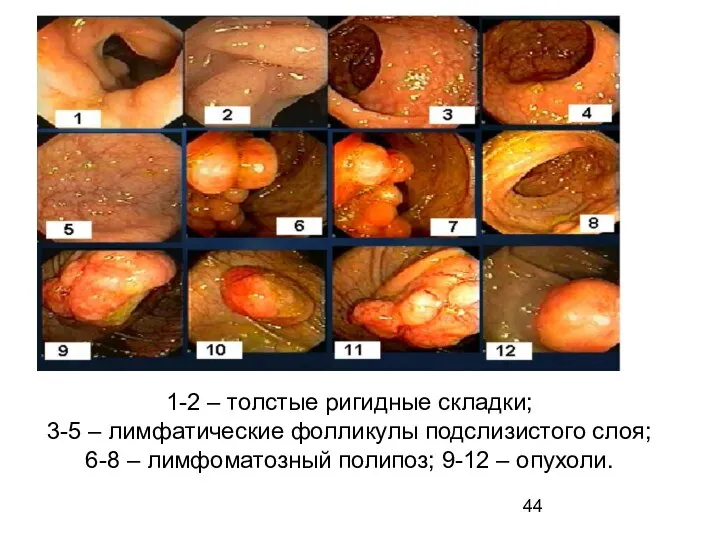
- 44. 1-2 – толстые ригидные складки; 3-5 – лимфатические фолликулы подслизистого слоя; 6-8 – лимфоматозный полипоз; 9-12
- 45. ЛКМЗ Ядерная экспрессия циклина Д1 клетками костномозгового субстрата лимфомы из клеток мантии. Иммуногистохимия, ув. 250
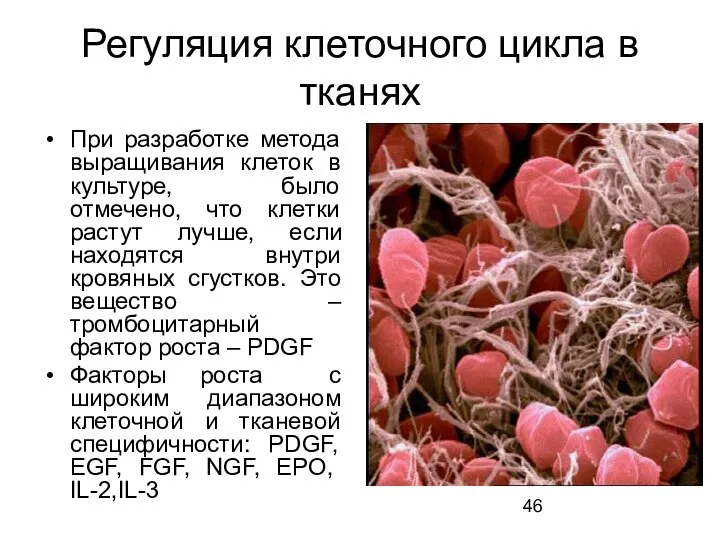
- 46. Регуляция клеточного цикла в тканях При разработке метода выращивания клеток в культуре, было отмечено, что клетки
- 47. Факторы роста Факторы роста Семейство тромбоцитарных факторов роста (PDGF) : PDGF A, PDGF B, VEGF, PLGF,CSF-1
- 48. Старение - феномен Хейфлика. Клетки запрограммированы на определенное число делений, а затем прекращают делиться Репликативное старение
- 49. Теломеры Теломеры-это концевые участки хромосом, которые содержат повторяющиеся последовательности ДНК и укорачиваются с каждой репликацией. В
- 50. Апоптоз – программируемая клеточная гибель. Регуляция процессов клеточного деления необходима для выживания организма. Размножение клеток зависит
- 51. Апоптоз – программируемая клеточная гибель. француз Бонне различал следующие четыре типа ядерной дегенерации: Кариорексис - хроматин
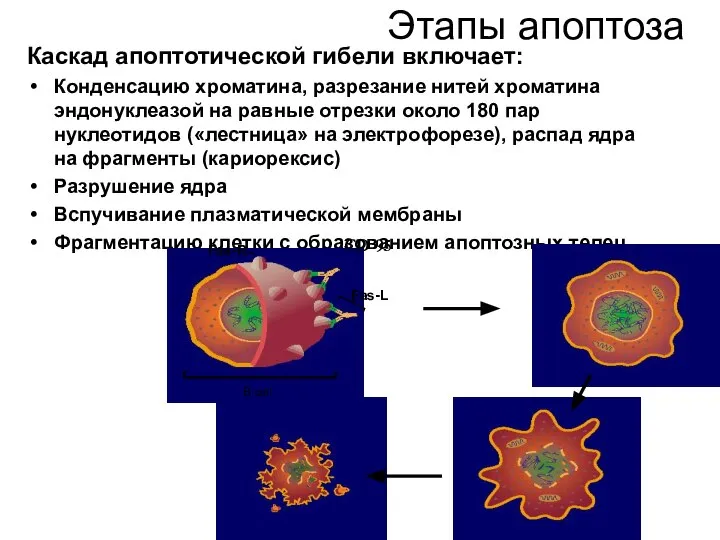
- 52. Этапы апоптоза Каскад апоптотической гибели включает: Конденсацию хроматина, разрезание нитей хроматина эндонуклеазой на равные отрезки около
- 53. Механизмы апоптоза 2 фазы: Формирование и проведение апоптотического сигнала –фаза принятия решения Демонтаж клеточных структур –эффекторная
- 54. Каспазы Семейство протеаз, участвующих в апоптозе Существует 14 видов каспаз Активаторы цитокинов (каспазы 1,4, 5, 13)
- 55. Сигнальные пути апоптоза Повреждение ДНК, радиация, токсические воздействия, глюкокортикоиды, укорочение теломер приводит к активации каспазы 9
- 56. Изменения мембран апоптотических клеток Клеточная мембрана апоптозной клетки теряет сиаловую кислоту на гликопротеинах и гликолипидах, входящих
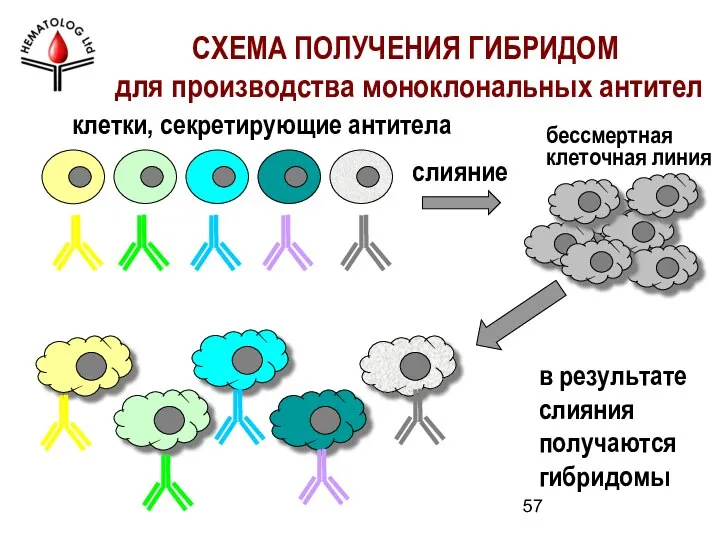
- 57. слияние в результате слияния получаются гибридомы СХЕМА ПОЛУЧЕНИЯ ГИБРИДОМ для производства моноклональных антител бессмертная клеточная линия
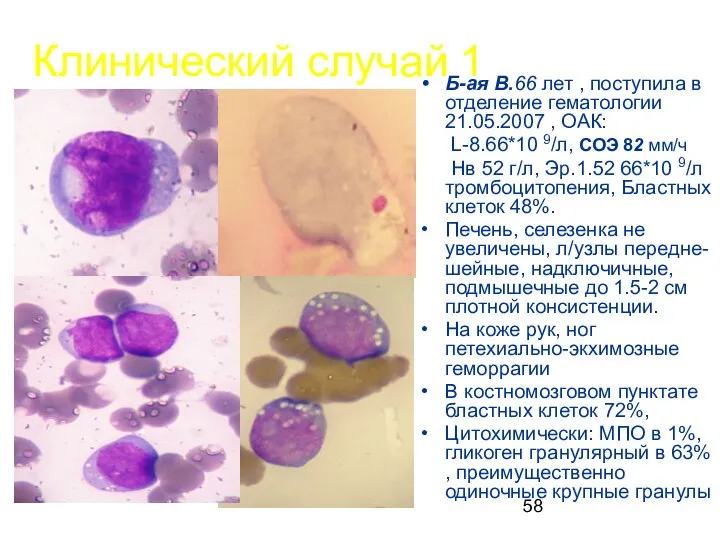
- 58. Клинический случай 1 Б-ая В.66 лет , поступила в отделение гематологии 21.05.2007 , ОАК: L-8.66*10 9/л,
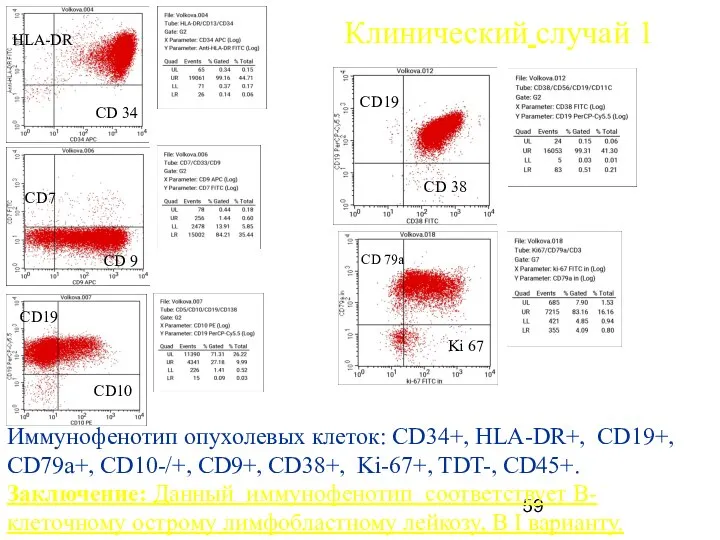
- 59. HLA-DR CD 34 CD7 CD 9 Клинический случай 1 Иммунофенотип опухолевых клеток: СD34+, HLA-DR+, СD19+, СD79а+,
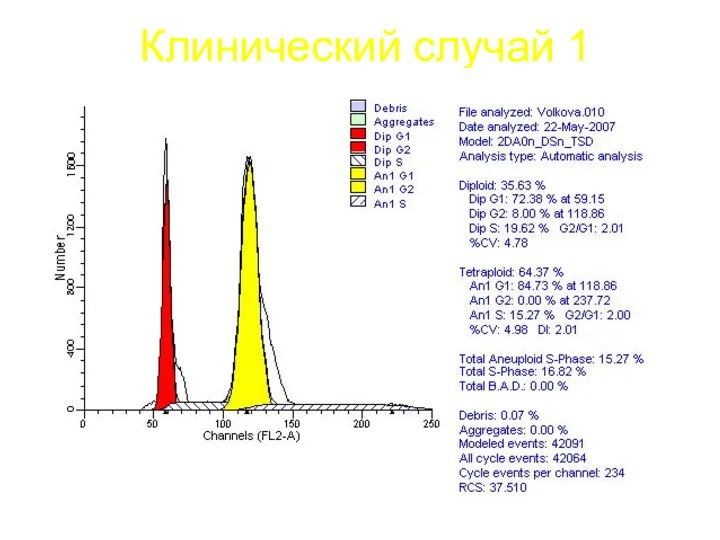
- 60. Клинический случай 1
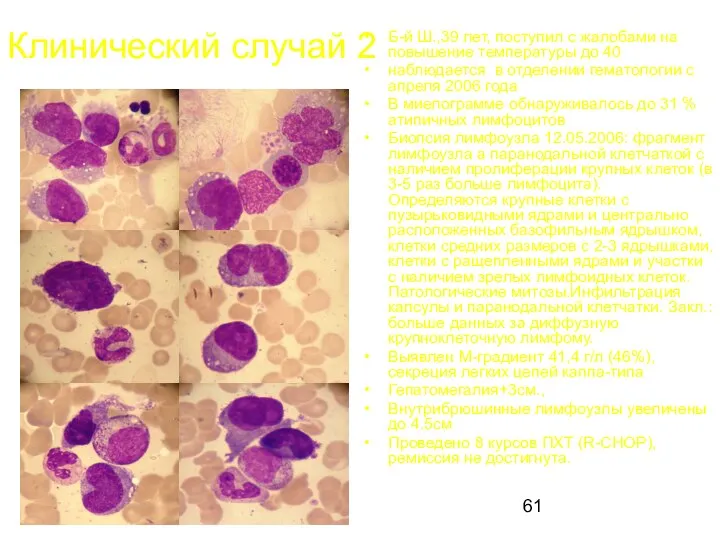
- 61. Клинический случай 2 Б-й Ш.,39 лет, поступил с жалобами на повышение температуры до 40 наблюдается в
- 62. Клинический случай 2 Заключение: Данный иммунофенотип в наибольшей степени соответствует плазмоклеточной пролиферации. Иммунофенотип опухолевых клеток: СD138+,
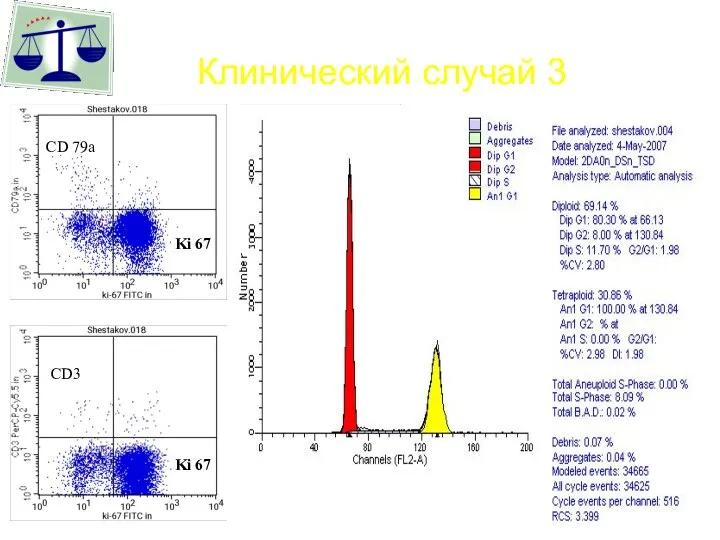
- 63. Клинический случай 3 Ki 67 Ki 67 CD 79a CD3
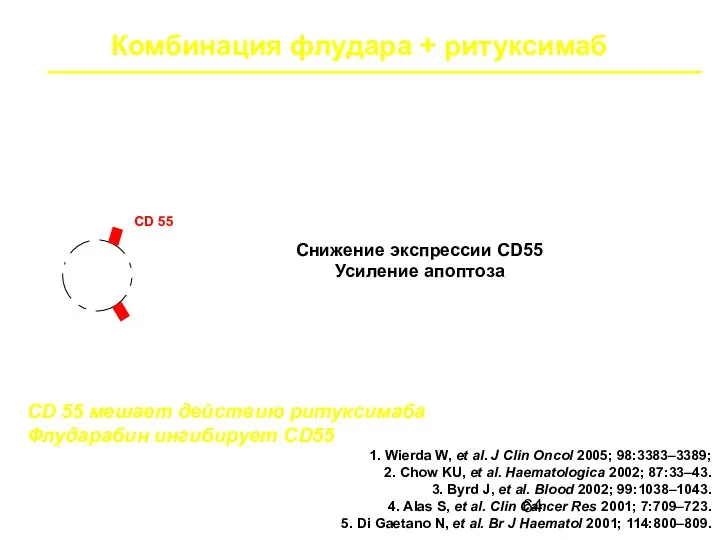
- 64. Комбинация флудара + ритуксимаб Функциональный синергизм CD55, CD46, CD59 CD 55 мешает действию ритуксимаба Флударабин ингибирует
- 65. Совместное российское исследование
- 66. Спасибо, что не вздремнули!
- 67. ЛИТЕРАТУРА Кассирский И.А. и Алексеев Г.А. Клиническая гематология. М., 1970; Максимов А.А. Основы гистологии, ч. 1—2,
- 69. Скачать презентацию





































 Основные сведения о насосах
Основные сведения о насосах 01.10 Недостающая фигура
01.10 Недостающая фигура Презентация на тему "Боль в неврологии" - скачать презентации по Медицине
Презентация на тему "Боль в неврологии" - скачать презентации по Медицине Презентация Керамика
Презентация Керамика Оборотные засоби
Оборотные засоби Римская республика во 2 веке до н.э.
Римская республика во 2 веке до н.э. Викторина "Урок (час) футбола" - 2
Викторина "Урок (час) футбола" - 2 Абсолютные и относительные величины в статистике.
Абсолютные и относительные величины в статистике. Невербальные средства коммуникации
Невербальные средства коммуникации Особенности проектирования зданий для сейсмических районов
Особенности проектирования зданий для сейсмических районов . Лечение микозов
. Лечение микозов По ту сторону холста… Автор: Петрова Юлия 10 «а» класс МОУ СОШ №17
По ту сторону холста… Автор: Петрова Юлия 10 «а» класс МОУ СОШ №17  Тепловые двигатели
Тепловые двигатели Учебно-тренировочный сбор «Твоё здоровье». Правила
Учебно-тренировочный сбор «Твоё здоровье». Правила Комплексы с 5-ю 6-ю электронными лигандами
Комплексы с 5-ю 6-ю электронными лигандами  Презентация Понятие и характеристика единой системы таможенных органов РФ
Презентация Понятие и характеристика единой системы таможенных органов РФ Подготовила: Шестёро Алина
Подготовила: Шестёро Алина  Основные понятия о системе движений. Задача биомеханики двигательных действий. (Лекция 2)
Основные понятия о системе движений. Задача биомеханики двигательных действий. (Лекция 2) Технология обучения детей 9-10 лет плаванию в условиях оздоровительной группы
Технология обучения детей 9-10 лет плаванию в условиях оздоровительной группы Технологии цифрового информационного моделирования на этапе территориального планирования
Технологии цифрового информационного моделирования на этапе территориального планирования Моє хобі - футбол
Моє хобі - футбол Соціальна політика Італії
Соціальна політика Італії Решение задания В8 (ЕГЭ-2014) (анализ численного алгоритма)
Решение задания В8 (ЕГЭ-2014) (анализ численного алгоритма) Диаграмма состояний. Диаграмма, которая представляет конечный автомат
Диаграмма состояний. Диаграмма, которая представляет конечный автомат Устав Муниципального образовательного учреждения «Средняя общеобразовательная школа № 52»
Устав Муниципального образовательного учреждения «Средняя общеобразовательная школа № 52» определение расстояний до звезд
определение расстояний до звезд Moderní cukrovar HROCHŮV TÝNEC
Moderní cukrovar HROCHŮV TÝNEC babushkina_oet_316
babushkina_oet_316