Содержание
- 2. Основные виды химической связи Зависимость энергии взаимодействия двух атомов от расстояния между ними: ЭПР – потенциальная
- 3. Основные виды химической связи Энергия и тип химической связи зависят от строения валентных оболочек В элементарных
- 4. Основные виды химической связи Форма и распроложение одноэлектронных атомных облаков в молекуле воды Ковалентная связь Молекула
- 5. Основные виды химической связи Ковалентная связь Распределение электронов по энергетическим состояниям в атомах углерода: а –
- 6. Основные виды химической связи Вид и структура алмаза Ковалентная связь Ковалентная связь характеризуется высокой прочностью, высокой
- 7. Основные виды химической связи Ионная связь Ионная связь возникает вследствие перехода валентных электронов от металлического атома
- 8. Основные виды химической связи Ионная связь Количество ближайших соседей, окружающих данный ион в кристаллической решетке, называют
- 10. Основные виды химической связи Молекулярная связь (связь Ван-дер-Ваальса) Наблюдается у ряда веществ между молекулами с ковалентным
- 12. Скачать презентацию
Основные виды химической связи
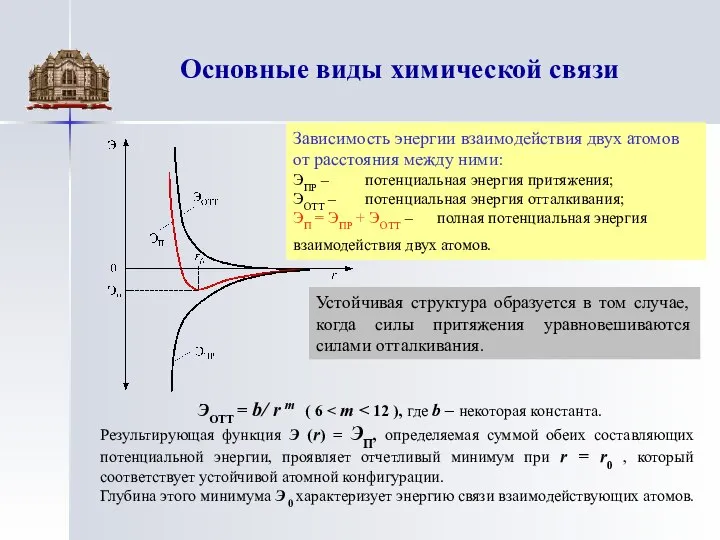
Зависимость энергии взаимодействия двух атомов от расстояния между
Основные виды химической связи
Зависимость энергии взаимодействия двух атомов от расстояния между
ЭПР – потенциальная энергия притяжения;
ЭОТТ – потенциальная энергия отталкивания;
ЭП = ЭПР + ЭОТТ – полная потенциальная энергия взаимодействия двух атомов.
Устойчивая структура образуется в том случае, когда силы притяжения уравновешиваются силами отталкивания.
ЭОТТ = b/ r m ( 6 < m < 12 ), где b – некоторая константа.
Результирующая функция Э (r) = ЭП, определяемая суммой обеих составляющих потенциальной энергии, проявляет отчетливый минимум при r = r0 , который соответствует устойчивой атомной конфигурации.
Глубина этого минимума Э 0 характеризует энергию связи взаимодействующих атомов.
Основные виды химической связи
Энергия и тип химической связи зависят от строения
Основные виды химической связи
Энергия и тип химической связи зависят от строения
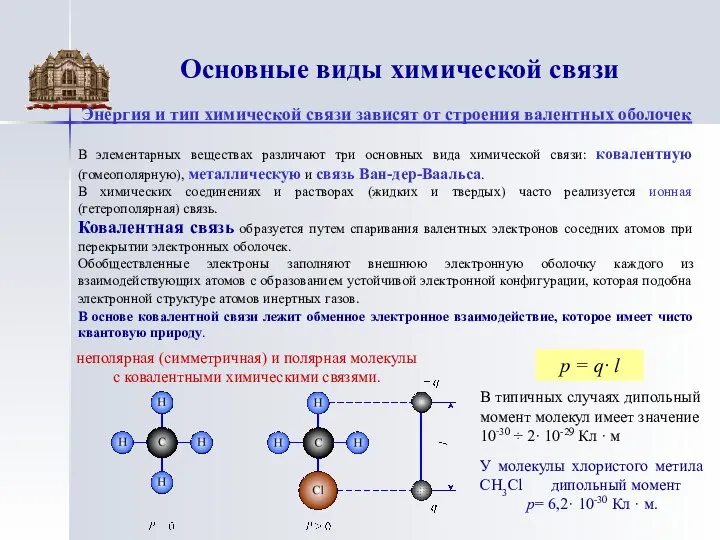
В элементарных веществах различают три основных вида химической связи: ковалентную (гомеополярную), металлическую и связь Ван-дер-Ваальса.
В химических соединениях и растворах (жидких и твердых) часто реализуется ионная (гетерополярная) связь.
Ковалентная связь образуется путем спаривания валентных электронов соседних атомов при перекрытии электронных оболочек.
Обобществленные электроны заполняют внешнюю электронную оболочку каждого из взаимодействующих атомов с образованием устойчивой электронной конфигурации, которая подобна электронной структуре атомов инертных газов.
В основе ковалентной связи лежит обменное электронное взаимодействие, которое имеет чисто квантовую природу.
неполярная (симметричная) и полярная молекулы
с ковалентными химическими связями.
p = q· l
У молекулы хлористого метила CH3Cl дипольный момент
p= 6,2· 10-30 Кл · м.
В типичных случаях дипольный момент молекул имеет значение 10‑30 ÷ 2· 10-29 Кл · м
Основные виды химической связи
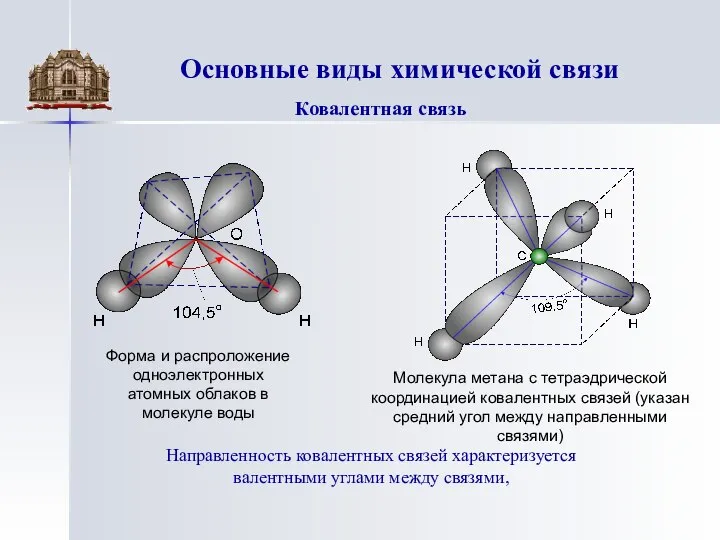
Форма и распроложение одноэлектронных атомных облаков в молекуле
Основные виды химической связи
Форма и распроложение одноэлектронных атомных облаков в молекуле
Ковалентная связь
Молекула метана с тетраэдрической координацией ковалентных связей (указан средний угол между направленными связями)
Направленность ковалентных связей характеризуется
валентными углами между связями,
Основные виды химической связи
Ковалентная связь
Распределение электронов по энергетическим состояниям в атомах
Основные виды химической связи
Ковалентная связь
Распределение электронов по энергетическим состояниям в атомах
а – уединенный атом в основном состоянии;
б – гибридные орбитали в структурах с тетраэдрической координацией
При образовании молекулы атомы могут возбуждать друг друга и производить «распаривание» некоторых электронов. В частности, при образовании молекулы СН4 один из электронов атома углерода вследствие возбуждения переходит из 2s-состояния в свободную 2p-ячейку (б). В результате такого перехода в атоме углерода возникает четыре электрона с некомпенсированными спинами, которые способны участвовать в образовании четырех sp3 - гибридных ковалентных связей.
Гибридизация валентных электронов углеродного атома сопровождается искажением их электронных облаков. Вместо конфигураций, свойственных s- и p-состояниям, облака каждого электрона при sp3- гибридизации приобретают резко асимметричную форму, вытянутую в одну сторону от ядра атома и одинаковую для всех четырех электронов
Основные виды химической связи
Вид и структура алмаза
Ковалентная связь
Ковалентная связь характеризуется
Основные виды химической связи
Вид и структура алмаза
Ковалентная связь
Ковалентная связь характеризуется
и высокой температурой плавления таких веществ, как алмаз и карбид кремния.
Внутримолекулярные связи в органических молекулах с ковалентными связями также достаточно прочны, а низкие температуры плавления и низкая механическая прочность органических полимеров являются следствием межмолекулярных сил, которые не являются ковалентными.
Основные виды химической связи
Ионная связь
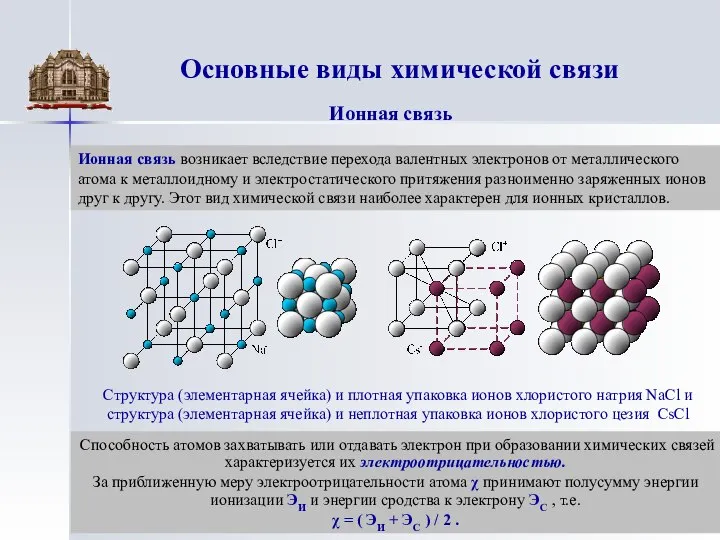
Ионная связь возникает вследствие перехода валентных электронов
Основные виды химической связи
Ионная связь
Ионная связь возникает вследствие перехода валентных электронов
Структура (элементарная ячейка) и плотная упаковка ионов хлористого натрия NaCl и
структура (элементарная ячейка) и неплотная упаковка ионов хлористого цезия CsCl
Способность атомов захватывать или отдавать электрон при образовании химических связей характеризуется их электроотрицательностью.
За приближенную меру электроотрицательности атома χ принимают полусумму энергии ионизации ЭИ и энергии сродства к электрону ЭС , т.е.
χ = ( ЭИ + ЭС ) / 2 .
Основные виды химической связи
Ионная связь
Количество ближайших соседей, окружающих данный ион в
Основные виды химической связи
Ионная связь
Количество ближайших соседей, окружающих данный ион в
Отношение ионных радиусов натрия и хлора r(Na+) / r(Cl-) равно 0,541. Для структуры NaCl координационное число К = 6, т.е. каждый катион натрия должен находится в октаэдрическом окружении шести анионов хлора.
В кристаллах CsCl r(Cs+) / r(Cl-) = 0,912, т.е. ион цезия достаточно велик, чтобы вокруг него расположилось 8 анионов хлора, не соприкасаясь друг с другом, без появления сил отталкивания между их электронными оболочками.
Решетка объемно- центрированного куба, в которой кристаллизуется CsCl , отличается наиболее плотной упаковкой.
Изменение соотношения размеров частиц влечет за собой смену типа кристаллической решетки.
Допустимые диапазоны изменения отношения rK/rA для ионных кристаллов с различным координационным числом:
Основные виды химической связи
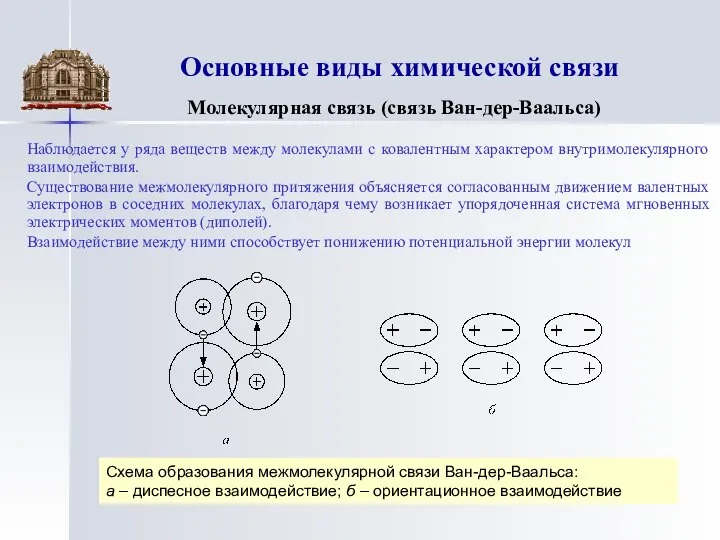
Молекулярная связь (связь Ван-дер-Ваальса)
Наблюдается у ряда веществ
Основные виды химической связи
Молекулярная связь (связь Ван-дер-Ваальса)
Наблюдается у ряда веществ
Существование межмолекулярного притяжения объясняется согласованным движением валентных электронов в соседних молекулах, благодаря чему возникает упорядоченная система мгновенных электрических моментов (диполей).
Взаимодействие между ними способствует понижению потенциальной энергии молекул
Схема образования межмолекулярной связи Ван-дер-Ваальса:
а – диспесное взаимодействие; б – ориентационное взаимодействие




 BPR-реинжиниринг по Хаммеру и Чимпи
BPR-реинжиниринг по Хаммеру и Чимпи  Паркинг. Автолюбители за парковку не платят
Паркинг. Автолюбители за парковку не платят Bios и загрузка оперативной системы
Bios и загрузка оперативной системы Sieci komputerowe. Sieci-intro
Sieci komputerowe. Sieci-intro Современные школы и направления в теории международных отношений. (Лекции 4-5)
Современные школы и направления в теории международных отношений. (Лекции 4-5) Proverbi. Cibo
Proverbi. Cibo Закон Йеркса-Додсона
Закон Йеркса-Додсона  Большой адронный коллайдер
Большой адронный коллайдер Свойства функции У = sin x и ее график - презентация по Алгебре_
Свойства функции У = sin x и ее график - презентация по Алгебре_ Доклад
Доклад Юрий Владимирович Андропов
Юрий Владимирович Андропов Организационные основы службы скорой медицинской помощи. Оснащение машины СМП. Кафедра амбулаторной и скорой медицинской помощ
Организационные основы службы скорой медицинской помощи. Оснащение машины СМП. Кафедра амбулаторной и скорой медицинской помощ Иван Яковлевич БИЛИБИН (1876 -1942) Билибин – настоящий художник-сказочник: он знаменит своими изумительными иллюстрациями к ру
Иван Яковлевич БИЛИБИН (1876 -1942) Билибин – настоящий художник-сказочник: он знаменит своими изумительными иллюстрациями к ру Еңбек құқығы
Еңбек құқығы Презентация на тему "Мониторинг физической подготовленности среди 6-х классов" - скачать презентации по Педагогике
Презентация на тему "Мониторинг физической подготовленности среди 6-х классов" - скачать презентации по Педагогике Основы военной связи. Общая тактика
Основы военной связи. Общая тактика Середовища програмування
Середовища програмування Презентация Гражданская война 1919-1920гг.
Презентация Гражданская война 1919-1920гг. К вопросу о формировании информационной культуры старшеклассников МОУ СОШ №2 г. Вяземского Шопова Н.Б.
К вопросу о формировании информационной культуры старшеклассников МОУ СОШ №2 г. Вяземского Шопова Н.Б. Классификация цифровых микросхем
Классификация цифровых микросхем Web-страница. Структура Web-страницы. 8 класс
Web-страница. Структура Web-страницы. 8 класс Организация работ по диагностированию, техническому обслуживанию и ремонту ЗИЛ-5301. Процесс ремонта переднего моста
Организация работ по диагностированию, техническому обслуживанию и ремонту ЗИЛ-5301. Процесс ремонта переднего моста Разговорник. Турецкий язык
Разговорник. Турецкий язык Программирование на Java
Программирование на Java Руководства по ремонту Husqvarna. Поиск запасных частей. Условия работы при гарантийном сервисе
Руководства по ремонту Husqvarna. Поиск запасных частей. Условия работы при гарантийном сервисе Основные положения административного права России
Основные положения административного права России  Разработка функциональных стратегий Тема 10
Разработка функциональных стратегий Тема 10  Из опыта работы: «Как оформить группу»
Из опыта работы: «Как оформить группу»