Содержание
- 2. П Л А Н 16.1 Пептиды, образование, элект-ронное и пространственное строение пептидной связи 16.2 Установление первичной
- 3. 16.1 ПЕПТИДЫ Среди производных α-аминокислот важнейшими являются амиды, где замещенная аминогруппа представляет собой остаток 2-й аминокислоты
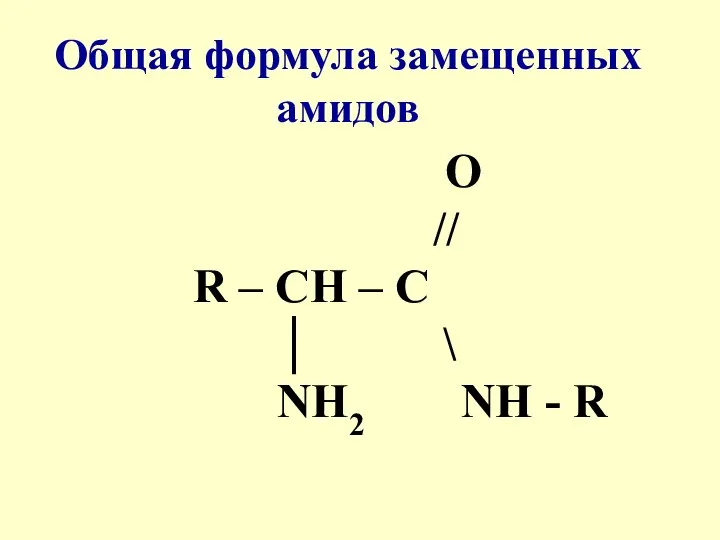
- 4. O // R – CH – C │ \ NH2 NH - R Общая формула замещенных
- 5. Пептиды - природные или синтетические вещества, построенные из остатков α-аминокислот, соединенных амидными (пептидными) связями
- 6. Амидная связь была названна пептидной связью Э. Фишером, он первым предположил первичную структуру для белков Э.
- 7. Функции пептидов 1. Выполняют функции биорегуляторов раз-личных биологических и физиологических процессов: регулируют тонус сосудов (вазопрессин, ангиотензин),
- 8. Пептидную природу имеют некоторые антибиотики (циклоспорин А, грамицидины), алкалоиды, токсины пчел и ос, змей, ядовитых грибов
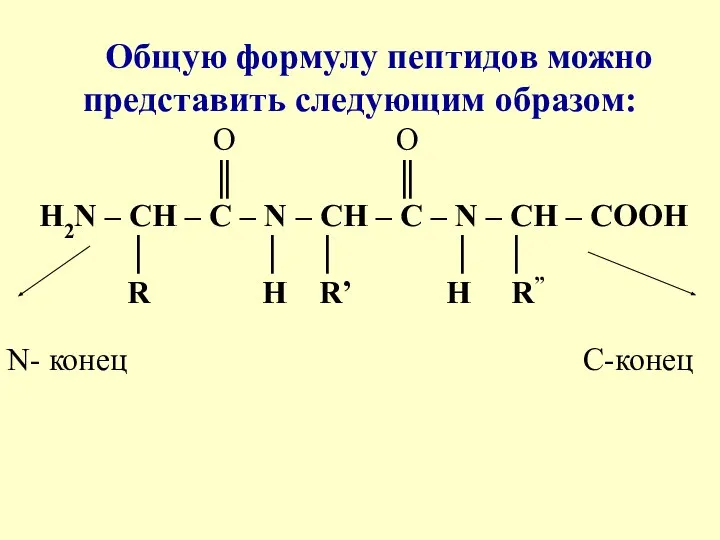
- 9. Общую формулу пептидов можно представить следующим образом: O O ║ ║ Н2N – СН – С
- 11. При построении названий пептидов в названии аминокислот окончание ин заменяется на ил, а название аминокислоты, содержащей
- 12. При построении белковых молекул с диамино- или дикарбоновыми аминокислотами в образовании пептидной связи участвуют α-NH2 или
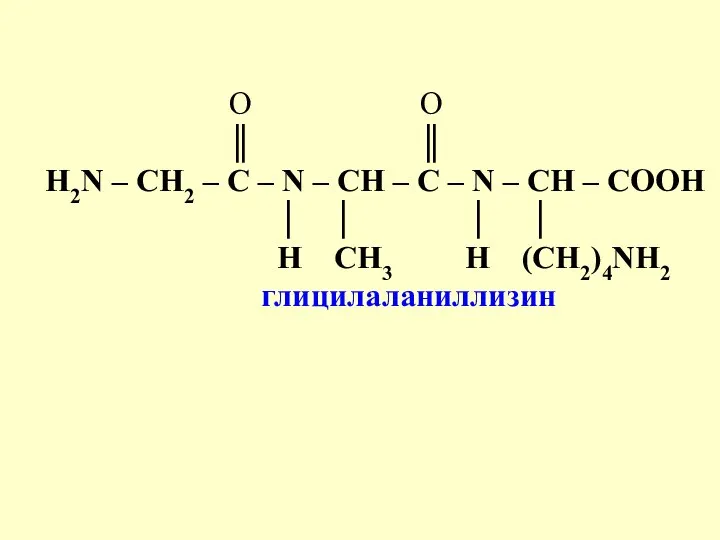
- 13. O O ║ ║ Н2N – СН2 – С – N – CH – C –
- 14. В проявлении биологических функций пептидов и белков важно их пространственное строение. Оно определяется электронным строением пептидной
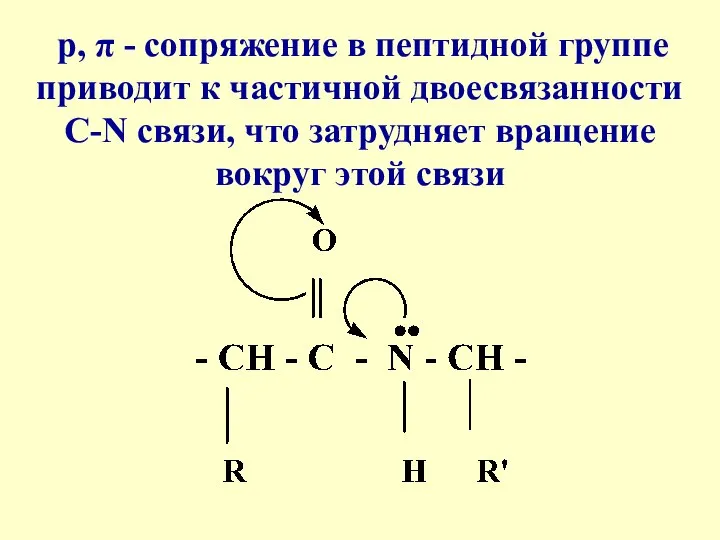
- 15. p, π - сопряжение в пептидной группе приводит к частичной двоесвязанности С-N связи, что затрудняет вращение
- 16. Такая частичная двоесвязанность C-N связи означает, что пептидная группа представляет собой плоский участок пептидной цепи, рядом
- 19. Химические свойства пептидов вытекают из их амидной природы, они способны гидролизоваться в кислой и щелочной средах,
- 20. Первичная структура пептидов и белков- последовательность остатков α-аминокислот
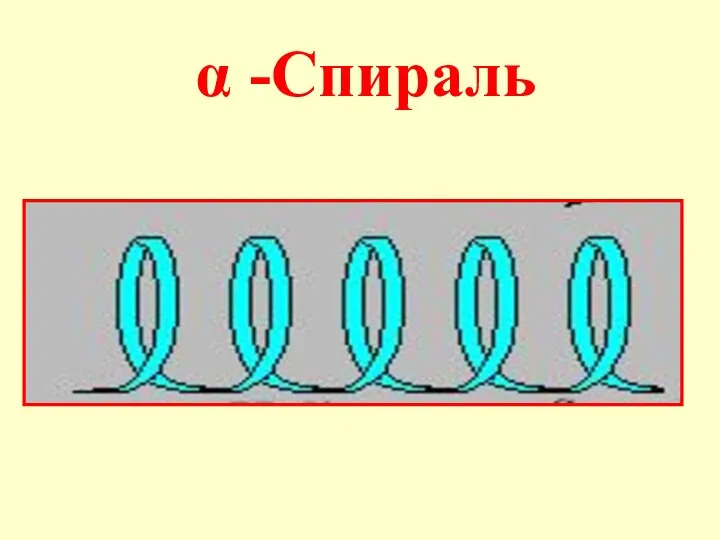
- 22. Вторичная структура пептидов - пространственное расположение цепи (конформация), фиксируемое водородными связями. Отдельные участки цепи образуют α-спираль,
- 24. В одном витке спирали умещаются 3,6 аминокислотных остатка, т.е. каждая аминокислота связывается с 5-ой по счету
- 25. В пептидах возможны другие виды взаимодействий, приводящие к стабилизации цепи в пространстве: ионные между заряженными группами
- 26. 16.2 Установление первичной структуры пептидов Первичная структура пептидов и белков определяется путем последовательного отщепления α-аминокислот с
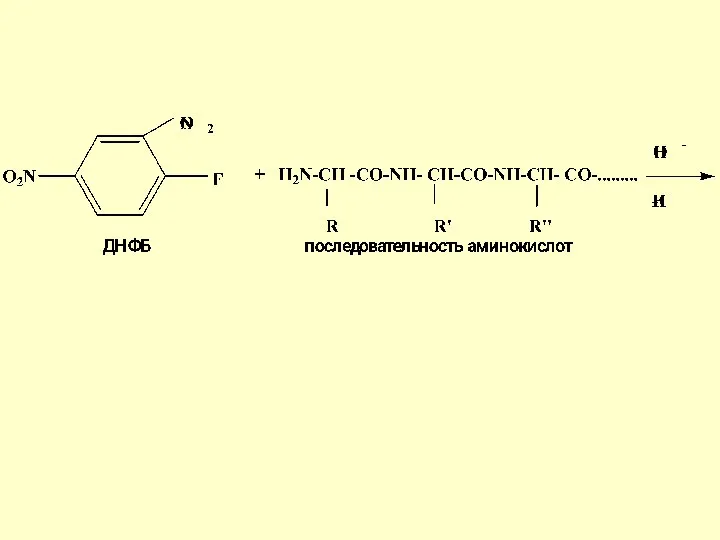
- 27. Метод Сенгера - один из первых методов с 2,4-динитрофторбензолом (ДНФБ) Ф. Сенгер
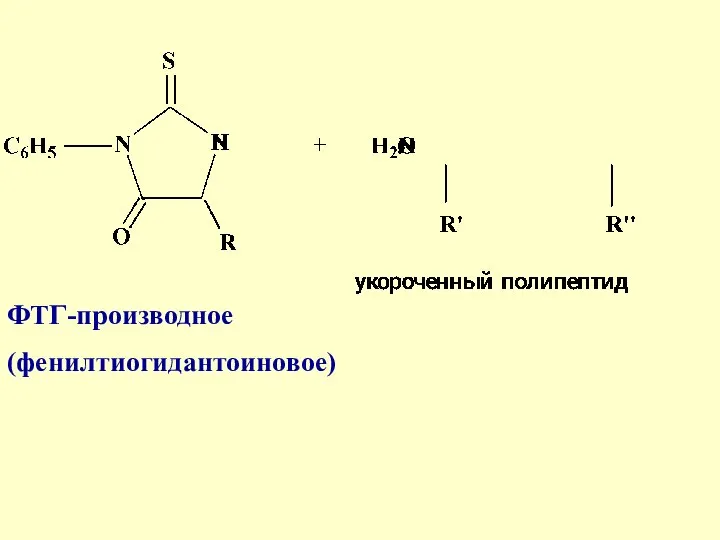
- 30. Метод Эдмана с фенилизотиоцианатом (ФТГ)
- 31. Преимуществом этого метода является то, что при отщеплении каждой N-концевой α-аминокислоты, остальная часть пептидной молекулы не
- 33. ФТГ-производное (фенилтиогидантоиновое)
- 34. Метод Эдмана лежит в основе автоматического прибора - секвенатора (sequence от английского - последовательность), аминокислотный анализатор.
- 36. 16.3 Стратегия пептидного синтеза Схематично рассмотрим синтез дипептида ГЛИ –ЛЕЙ Для осуществления синтеза пептида с заданной
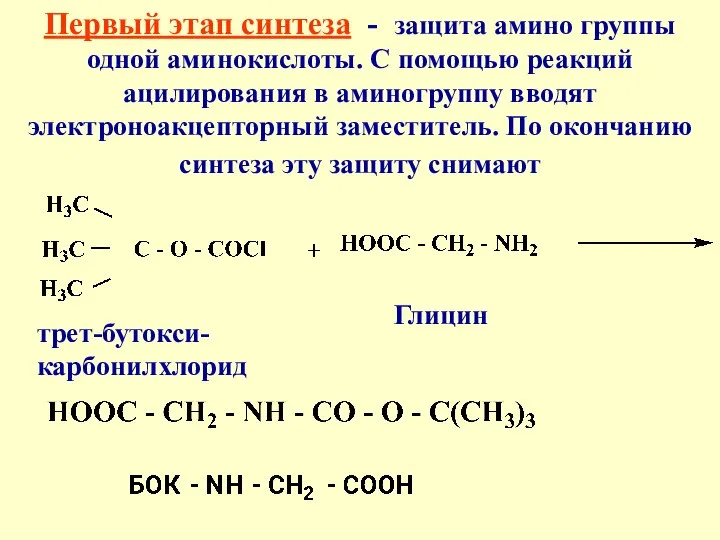
- 37. Первый этап синтеза - защита амино группы одной аминокислоты. С помощью реакций ацилирования в аминогруппу вводят
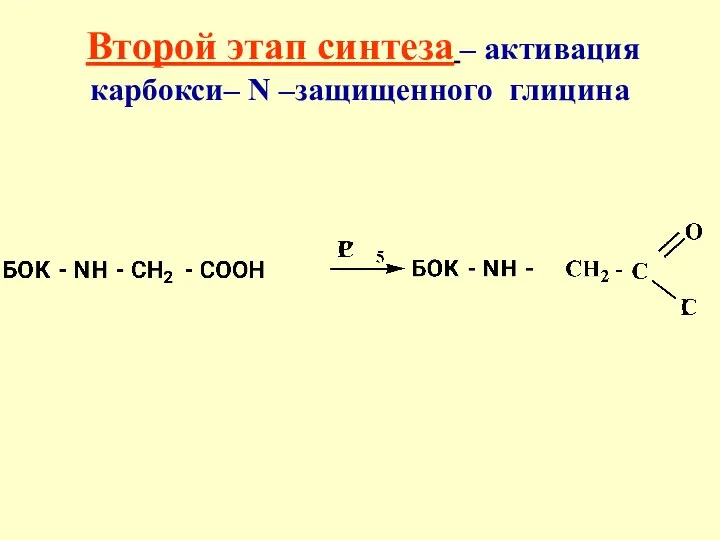
- 38. Второй этап синтеза – активация карбокси– N –защищенного глицина
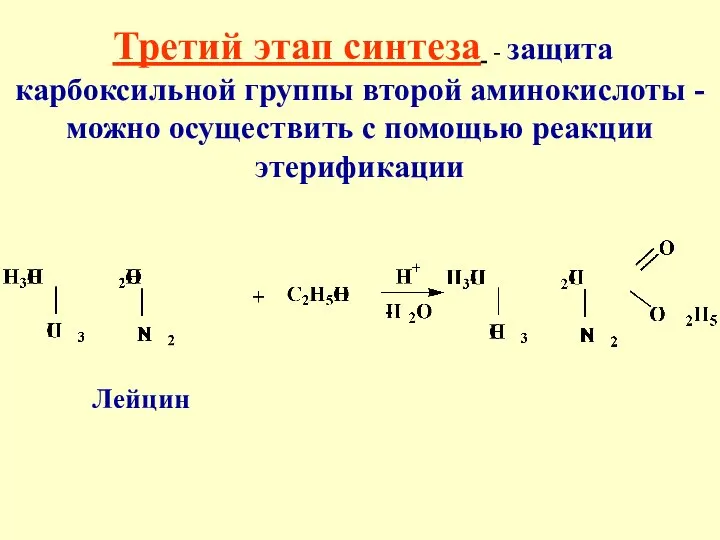
- 39. Третий этап синтеза - защита карбоксильной группы второй аминокислоты -можно осуществить с помощью реакции этерификации Лейцин
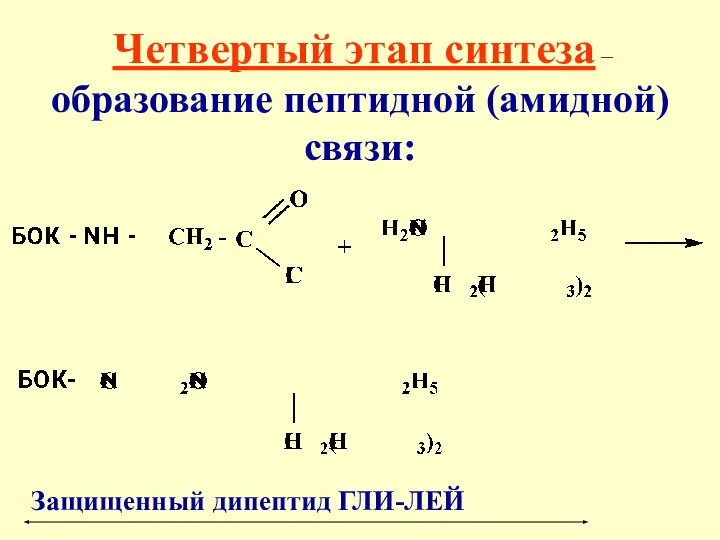
- 40. Четвертый этап синтеза – образование пептидной (амидной) связи: Защищенный дипептид ГЛИ-ЛЕЙ
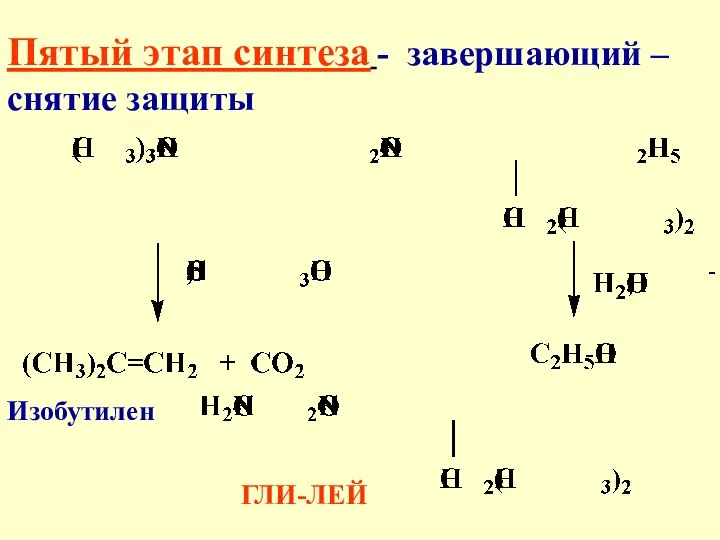
- 41. Пятый этап синтеза - завершающий – снятие защиты ГЛИ-ЛЕЙ Изобутилен
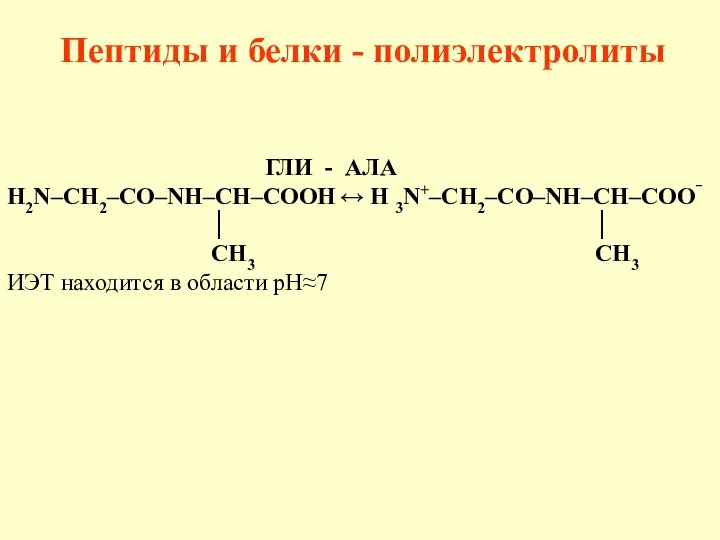
- 42. Пептиды и белки - полиэлектролиты ГЛИ - АЛА H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾ │ │ CH3 СН3
- 43. ГЛИ - ГЛУ H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾ │ │ (CH2)2 -СООН НООС–(СН2)2 ИЭТ находится в области
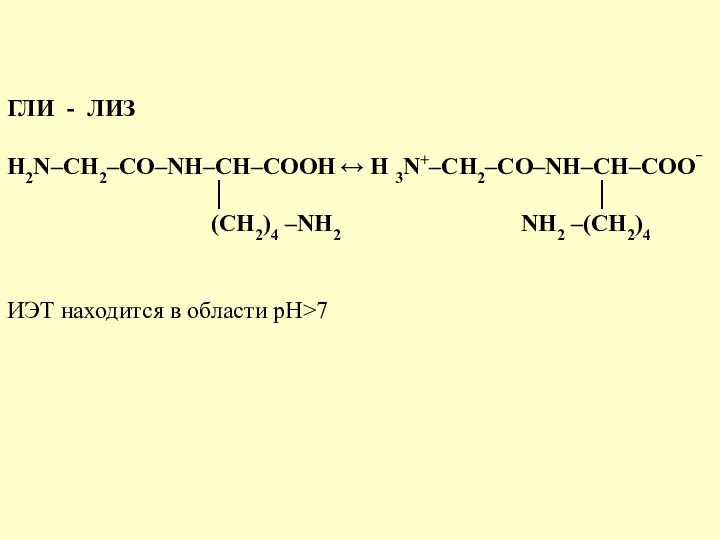
- 44. ГЛИ - ЛИЗ H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾ │ │ (CH2)4 –NН2 NН2 –(СН2)4 ИЭТ находится в
- 45. 16.4 БЕЛКИ Белки - высокомолекулярные азотсодержащие биологические макромолекулы, состоящие из биогенных α, L-аминокислот, связанных в линейную
- 46. Простейший белок – полипептид, содержащий в своей структуре не менее 70 аминокислотных остатков
- 47. Белки – важнейшие компоненты клетки, на их долю приходится не менее 50% сухого веса. Они осуществляют
- 48. Биологическая роль белков 1. Каталитическая функция 2. Питательная (резервная) 3. Транспортная 4. Защитная функция 5. Сократительная
- 49. Пищевую ценность белка определяют содержанием незаменимых аминокислот - не синтезируются в организме ВАЛИН, ЛЕЙЦИН, ИЗОЛЕЙЦИН, ТРЕОНИН,
- 50. Гистидин и аргинин частично заменимые аминокислоты
- 52. Первичная структура – линейная последовательность биогенных аминокислот, связанных пептидными связями. Первичная структура определяет и более высокие
- 53. Вторичная структура – локальная конформация полипептидной цепи, возникающая в результате вращения отдельных ее участков, приводящая к
- 54. α -Спираль
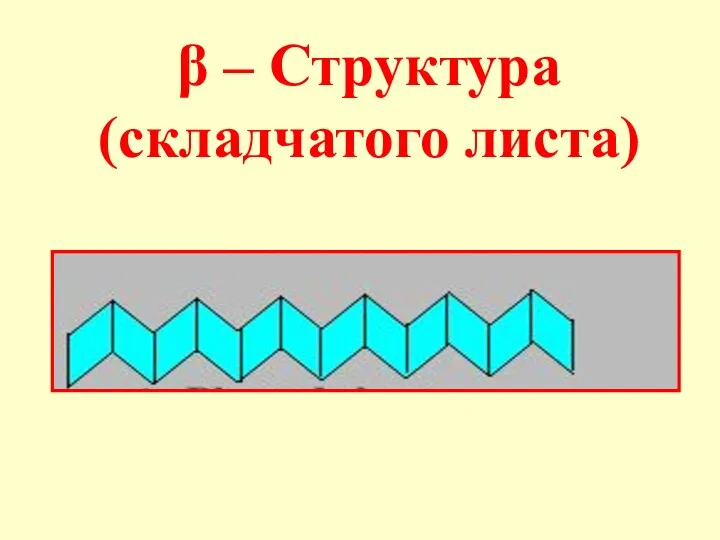
- 55. β – Структура (складчатого листа)
- 57. Третичная структура - конформация (расположение в пространстве) всей полипептидной цепи. В ее формировании и стабилизации принимают
- 60. Четвертичная структура белка- способ укладки в пространстве отдельных полипептидных цепей (одинаковых или разных) с третичной структурой,
- 62. Каждая отдельная полипептидная цепь в структуре мультимера называется протомером. Протомеры стерически комплементарны и связывают структуру нековалентными
- 63. Гемоглобин – белок эритроцитов, относится к группе гемопротеинов, участвует в транспорте газов в организме. В качестве
- 64. Молекула гемоглобина в отличие от миоглобина обнаруживает ряд существенных особенностей: 1 Кислород связывается молекулой гемоглобина кооперативно,
- 65. Физико-химические свойства белков Белки образуют коллоидные растворы, рассеивают проходящий свет, обладают гидрофильными свойствами, способны связывать воду,
- 66. Денатурация – процесс разрушения природной макроструктуры белков под влиянием ряда факторов: химических веществ (фенол, мочевина), повышенной
- 67. Цветные реакции белков обусловлены наличием в растворе белка аминокислоты отдельных групп или определенных связей БИУРЕТОВАЯ РЕАКЦИЯ
- 68. НИНГИДРИНОВАЯ РЕАКЦИЯ - появление фиолетового окрашивания при взаимодействии с нингидрином - обусловлена наличием свободных аминогрупп в
- 69. КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ - появление желто-коричневого окрашивания при действии концентрированной азотной кислотой - обусловлена наличием в белках
- 70. РЕАКЦИЯ МИЛОНА - - при действии на белок смеси азотно- и азотистокислых солей ртути, белок вначале
- 71. РЕАКЦИЯ АДАМКЕВИЧА - при действии на белок концентрированной уксусной кислоты с примесью глиоксиловой кислоты на границе
- 72. РЕАКЦИЯ ФОЛЯ - нагревание белка со щелочью и солью свинца приводит к выпадению черного осадка -
- 74. Скачать презентацию
























































 МОУ КРУТИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 3 Педагогический проект «Слагаемые успеха»
МОУ КРУТИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 3 Педагогический проект «Слагаемые успеха» Имкотермс
Имкотермс Габариты на железнодорожном транспорте и их назначение
Габариты на железнодорожном транспорте и их назначение Универсальные приводы
Универсальные приводы Экология в политике XXI века
Экология в политике XXI века Презентация «ЭНЕРГОСНАБЖЕНИЕ»
Презентация «ЭНЕРГОСНАБЖЕНИЕ» Древние образы и символы в народном искусстве.Часть 1
Древние образы и символы в народном искусстве.Часть 1 Эксплуатационная работа железных дорог
Эксплуатационная работа железных дорог Пять великих математиков
Пять великих математиков Требования к профессиональному мастерству и физической натренированности сотрудника ГПС
Требования к профессиональному мастерству и физической натренированности сотрудника ГПС Рекурсия. Сортировка слиянием. Восходящая сортировка слиянием. Сложность сортировки. Устойчивость сортировок
Рекурсия. Сортировка слиянием. Восходящая сортировка слиянием. Сложность сортировки. Устойчивость сортировок Электронные платежные системы в России
Электронные платежные системы в России  СВОБОДНОЕ
СВОБОДНОЕ Перші автомобілі в історії
Перші автомобілі в історії Порядок проведения испытаний и утверждения типа средств измерений
Порядок проведения испытаний и утверждения типа средств измерений  Презентация Экспертиза маргарина
Презентация Экспертиза маргарина Краткая презентация основной общеобразовательной программы МДОАУ «Детский сад № 95 г. Орска»
Краткая презентация основной общеобразовательной программы МДОАУ «Детский сад № 95 г. Орска»  Тестирование мобильных приложений с нуля. Как определить покрытие?
Тестирование мобильных приложений с нуля. Как определить покрытие? Презентация Семейное право
Презентация Семейное право Презентация "Разработка и принятие управленческих решений" - скачать презентации по Экономике
Презентация "Разработка и принятие управленческих решений" - скачать презентации по Экономике Единство детей божьих
Единство детей божьих Страна богатой культуры и истории - Индия
Страна богатой культуры и истории - Индия Расчет трансформатора. (Лекция 2)
Расчет трансформатора. (Лекция 2) Гендерная социализация
Гендерная социализация  Творчество Грибоедова Учитель русского языка и литературы Маскаева Евгения Владимировна
Творчество Грибоедова Учитель русского языка и литературы Маскаева Евгения Владимировна Семь шагов к успеху, или основные правила разработки проекта
Семь шагов к успеху, или основные правила разработки проекта Контрольный тест для проверки знаний специалиста по охране труда, на IV группу по электробезопасности. (Тема 8)
Контрольный тест для проверки знаний специалиста по охране труда, на IV группу по электробезопасности. (Тема 8) ВЫБОР ПОТРЕБИТЕЛЯ И ФАКТОРЫ ВЛИЯЮЩИЕ НА НЕГО. Студентка группы ММ – 10 Абильтарова Лиля
ВЫБОР ПОТРЕБИТЕЛЯ И ФАКТОРЫ ВЛИЯЮЩИЕ НА НЕГО. Студентка группы ММ – 10 Абильтарова Лиля