Содержание
- 2. Лекция 15. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА 1. Внутренняя энергия. Работа и теплота.
- 3. Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы
- 4. Область применения термодинамики значительно шире, чем молекулярно-кинетической теории, ибо нет таких областей физики и химии, в
- 5. Термодинамика анализирует условия и количественные соотношения превращения энергии. Термодинамика имеет дело с термодинамической системой - совокупностью
- 6. Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно
- 7. Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного
- 8. Термодинамическое равновесие существенно отличается от механического тем, что хотя параметры системы остаются неизменными, частицы, из которых
- 9. Исторически раньше сложилась термодинамика, или общая теория теплоты. Термодинамика является феноменологической наукой. Она не вводит никаких
- 10. Термодинамика возникла в XIX веке как теоретическая основа начавшей развиваться теплотехники. Её первоначальная задача – изучение
- 11. О тепловом движении можно говорить только в тех случаях, когда рассматриваемая система является макроскопической, то есть
- 12. Время перехода – время релаксации. Если равновесие установилось, то система самопроизвольно не сможет выйти из него.
- 13. 1. Внутренняя энергия. Работа и теплота Наряду с механической энергией любое тело (или система) обладает внутренней
- 14. В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома,
- 15. Изменение внутренней энергии U равно разности внутренней энергии в этих состояниях, независимо от пути, по которому
- 16. Если же камень был холодный, т.е. температура камня равна температуре среды, то будет совершена только работа,
- 17. Опыт показывает, что во всех случаях превращение механической энергии в тепловую и обратно совершается всегда в
- 18. Учитывая правило знаков можно записать: U = Q – А (15.3) изменение внутренней энергии тела равно
- 19. Первое начало термодинамики Первое начало термодинамики есть закон сохранения энергии для макроскопических явлений, в которых одним
- 20. При контакте термодинамической системы с окружающей средой происходит обмен энергией. Возможны два различных способа передачи энергии
- 21. Затрачиваемая работа А может пойти на увеличение любого вида энергии, теплота Q непосредственно может пойти только
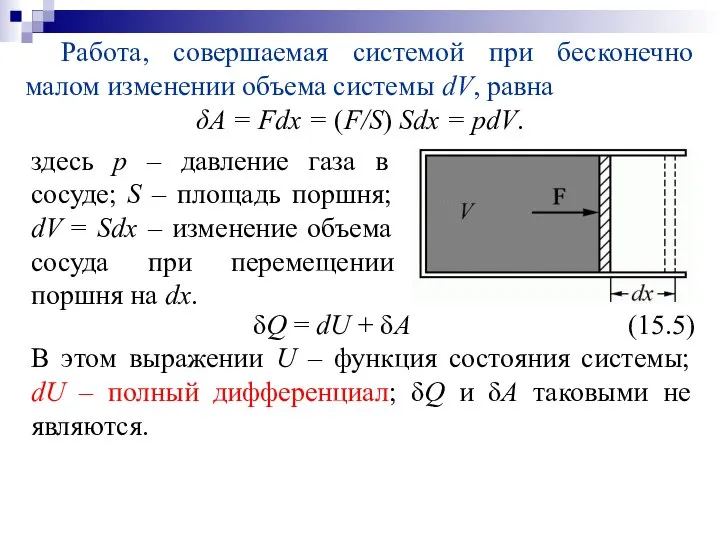
- 22. Работа, совершаемая системой при бесконечно малом изменении объема системы dV, равна δA = Fdx = (F/S)
- 23. В каждом состоянии система обладает определенным и только таким значением внутренней энергии, поэтому можно записать (15.6)
- 24. Величины δQ и δA бесконечно малы, но не являются полными дифференциалами, поскольку Q и A задаются
- 25. Из формулы (15.5) следует, что количество теплоты выражается в тех же единицах, что работа и энергия,
- 26. Если ΔU=0, то согласно первому началу термо-динамики А=Q, т.е. нельзя построить периодически действующий двигатель, который совершал
- 27. 2. Теплоёмкость идеального газа. Уравнение Майера Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела
- 28. Для газов удобно пользоваться молярной тепло-емкостью Сμ − количество теплоты необходимое для нагревания 1 кмоля газа
- 29. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть
- 30. Итак, подводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Следовательно Q и
- 31. В общем случае (15.13) так как U может зависеть не только от температуры. Но в случае
- 32. Для произвольной идеальной массы газа: (15.16) При изобарическом процессе кроме увеличения внутренней энергии происходит совершение работы
- 33. Подставим полученный результат в уравнение (15.18) СР = СV+R (15.19) это уравнение Майера для одного моля
- 34. 3. Теплоёмкости одноатомных и многоатомных газов Напомню, что в одном моле содержится NА = 6,02⋅1023 молекул.
- 35. Внутренняя энергия произвольного количества газа: (15.24) Её изменение: (15.25) Теплоёмкости одноатомных газов СV и СР: (15.26)
- 36. Учитывая физический смысл R для изобаричес-ких процессов можно записать: dQр = dUμ + RdT (для одного
- 37. Тогда и из этого следует, что (15.30) Кроме того Подставив в выражение для внутренней энергии: а
- 38. Теплоемкости многоатомных газов Однако опыты с азотом и кислородом и другими двухатомными газами дали А для
- 39. Положение материальной точки задаётся тремя координатами и она имеет три степени свободы. На каждую степень свободы
- 40. Итак, у двухатомных молекул пять степеней свободы (i = 5), а у трёхатомных шесть степеней свободы
- 41. 4. Закон о равномерном распределении энергии по степеням свободы Итак, средняя энергия приходящаяся на одну степень
- 42. Но на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы приходится (15.35) Это и есть закон Больцмана
- 43. В общем случае, для молярной массы газа (15.36) (15.37) (15.38) Для произвольного количества газов: (15.39) (15.40)
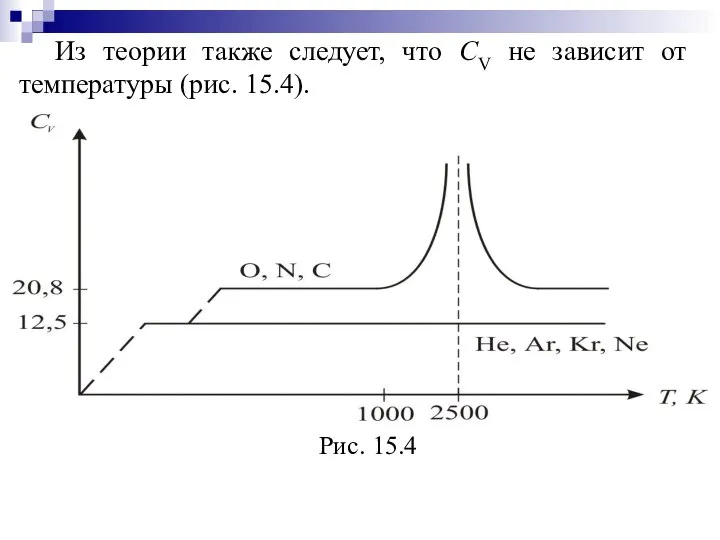
- 44. Из теории также следует, что СV не зависит от температуры (рис. 15.4).
- 45. Для одноатомных газов это выполняется в очень широких пределах, а для двухатомных газов только в интервале
- 46. Одна колебательная степень свободы несёт так как при этом есть и кинетическая и потенциальная энергия, то
- 47. 5. Применение первого начала термодинамики к изопроцессам идеальных газов В таблице (15.1) приводятся сводные данные о
- 48. - удельная теплоемкость; - молярная теплоемкость; Ср=СV+R - уравнение Майера; - показатель адиабаты или коэффициент Пуассона.
- 51. Здесь уместно рассмотреть еще и политропный процесс – такой процесс, при котором изменяются все основные параметры
- 52. С помощью этого показателя можно легко описать любой изопроцесс: 1. Изобарный процесс р = const, n
- 53. Лекция окончена!
- 55. Скачать презентацию


















































 Создание архитектурного облика водонапорных башен в муниципальных образованиях области
Создание архитектурного облика водонапорных башен в муниципальных образованиях области Встроенные объекты Java Script Array String Date
Встроенные объекты Java Script Array String Date Мусульманские праздники
Мусульманские праздники Структура управления организацией
Структура управления организацией Презентация "Виды пособий семьям, имеющим детей" - скачать презентации по Экономике
Презентация "Виды пособий семьям, имеющим детей" - скачать презентации по Экономике Химические концепции естествознания Химия как наука. Эволюция химических знаний
Химические концепции естествознания Химия как наука. Эволюция химических знаний Астана, февраль 2012 г.
Астана, февраль 2012 г. Испанский алфавит. Правила чтения
Испанский алфавит. Правила чтения Факультативное перестрахование
Факультативное перестрахование  Русская культура XVII в.
Русская культура XVII в.  неравенство доходов в обществе
неравенство доходов в обществе Структурная схема цифровой обработки сигналов
Структурная схема цифровой обработки сигналов Методы оценки персонала
Методы оценки персонала МУЛЬТИ-ПУЛЬТИ
МУЛЬТИ-ПУЛЬТИ  ЛОТРЕК
ЛОТРЕК Уровни и формы правосознания
Уровни и формы правосознания  Международный полит-экономический конгресс "Что будет после неолиберализма" Ал Кэмпбелл
Международный полит-экономический конгресс "Что будет после неолиберализма" Ал Кэмпбелл Міжнародны дзень роднай мовы
Міжнародны дзень роднай мовы Центральное экспертно-криминалистическое таможенное управление
Центральное экспертно-криминалистическое таможенное управление Территория АЗС
Территория АЗС Исследовательская работа « Изучение влияния корма на продолжительность жизни мух». Выполнила учащаяся 5 класса Дружинина Анна Сер
Исследовательская работа « Изучение влияния корма на продолжительность жизни мух». Выполнила учащаяся 5 класса Дружинина Анна Сер Презентация Физическая география Для хозяйственной оценки природных условий и ресурсов
Презентация Физическая география Для хозяйственной оценки природных условий и ресурсов  Коми региональная общественная организация “Федерация Киокушинкай”
Коми региональная общественная организация “Федерация Киокушинкай” Презентация «Организация таможенного контроля товаров и транспортных средств» на тему «Электронное декларирование»
Презентация «Организация таможенного контроля товаров и транспортных средств» на тему «Электронное декларирование» Презентация Структура гражданского правоотношения
Презентация Структура гражданского правоотношения Определение правил выбора школьного портфеля
Определение правил выбора школьного портфеля Казахская национальная кухня
Казахская национальная кухня Валы и оси. Подшипники
Валы и оси. Подшипники