Содержание
- 2. ИСТОРИЯ БИОХИМИИ – ЭТО ИСТОРИЯ ИССЛЕДОВАНИЯ ФЕРМЕНТОВ Эдвард Бухнер (1897) Экстрагировал ферменты из дрожжевых клеток http://chemistry.narod.ru
- 3. ИСТОРИЯ БИОХИМИИ – ЭТО ИСТОРИЯ ИССЛЕДОВАНИЯ ФЕРМЕНТОВ Эмиль Фишер Первые систематические исследования ферментов http://biographera.net
- 4. ИСТОРИЯ БИОХИМИИ – ЭТО ИСТОРИЯ ИССЛЕДОВАНИЯ ФЕРМЕНТОВ Джеймс Самнер (1926) Получил очищенные кристаллы уреазы wikimedia.org
- 5. ИСТОРИЯ БИОХИМИИ – ЭТО ИСТОРИЯ ИССЛЕДОВАНИЯ ФЕРМЕНТОВ Джон Нортроп Установил белковую природу ферментов Получил пепсин и
- 6. ФЕРМЕНТ Белковая молекула или молекула РНК или комплекс, выполняющий катализирующую функцию
- 7. РАЗМЕРЫ ФЕРМЕНТОВ 7,0 нм Молекула воды Активный центр Молекула субстрата Длина типичной молекулы субстрата 0,8 нм
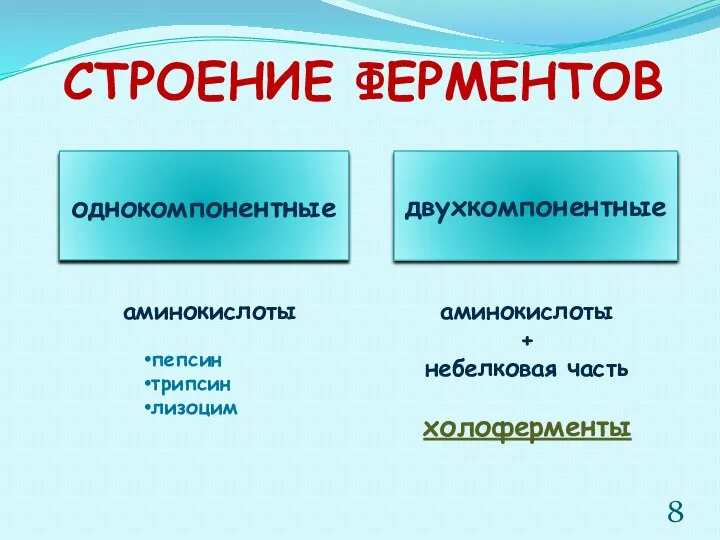
- 8. СТРОЕНИЕ ФЕРМЕНТОВ однокомпонентные двухкомпонентные аминокислоты аминокислоты + небелковая часть пепсин трипсин лизоцим холоферменты
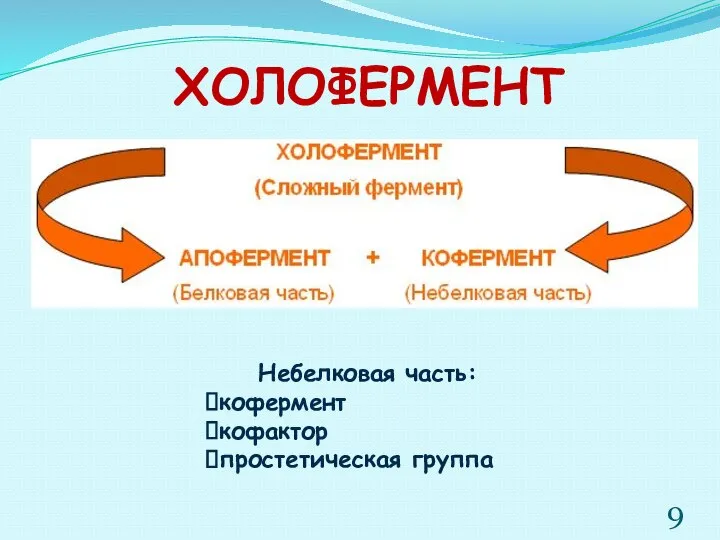
- 9. ХОЛОФЕРМЕНТ Небелковая часть: кофермент кофактор простетическая группа
- 10. КОФЕРМЕНТ Изолированная низкомолекулярная небелковую часть, легко удаляемая через полупроницаемую мембрану при диализе
- 11. прочно связана с апоферментом ковалентными связями отделенный апобелок лишается ферментативной активности ПРОСТЕТИЧЕСКАЯ ГРУППА
- 12. КОФАКТОР органические неорганические витамины нуклеотиды динуклеотиды железопорфирины липоевая кислота ионы металлов Mg2+, Мn2+, Са2+)
- 13. только объединение кофактора и апофермента в одно целое, протекающее в соответствии с программой их структурной организации,
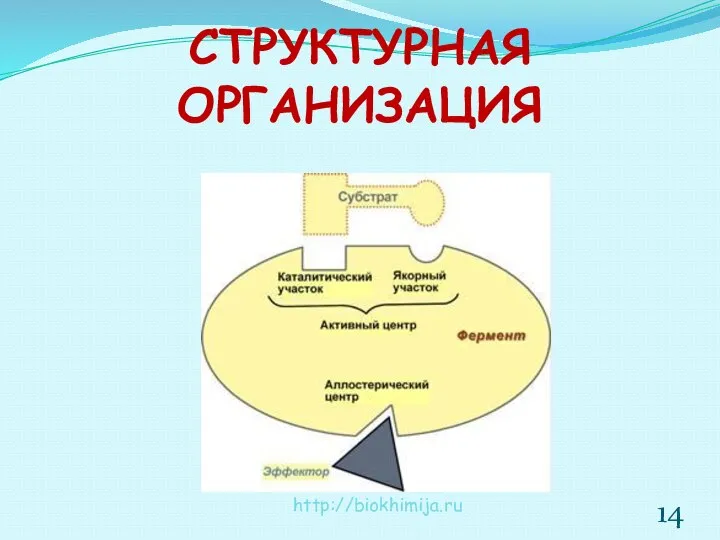
- 14. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ http://biokhimija.ru
- 15. АКТИВНЫЙ ЦЕНТР область фермента, в которой происходит связывание и превращение субстрата Наиболее часто в состав активных
- 16. образуется радикалами аминокислотных остатков полипептида при формировании третичной структуры; у двухкопонентных ферментов в состав активного центра
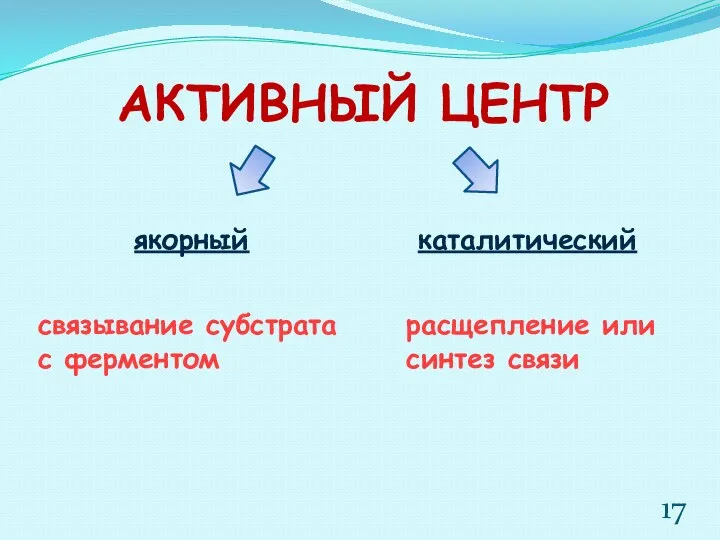
- 17. АКТИВНЫЙ ЦЕНТР якорный каталитический расщепление или синтез связи связывание субстрата с ферментом
- 18. центр регуляции активности фермента АЛЛОСТЕРИЧЕСКИЙ ЦЕНТР есть не у всех ферментов пространственно отделен от активного центра
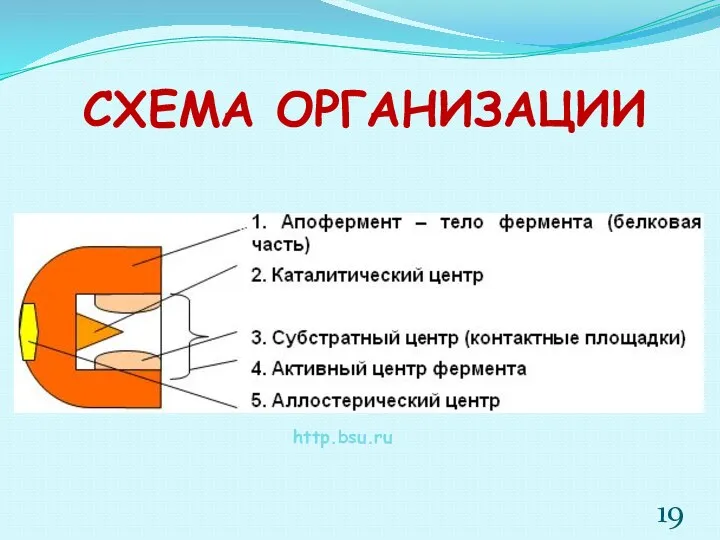
- 19. СХЕМА ОРГАНИЗАЦИИ http.bsu.ru
- 20. ПРОВЕРЬТЕ СВОИ ЗНАНИЯ 1. Все ферменты – вещества, состоящие из белков? нет, некоторые имеют РНК-природу 2.
- 21. ПОЧЕМУ… Молекулы ферментов крупнее молекул субстратов? Каким образом аминокислоты, сами по себе не способные ускорять химические
- 23. Скачать презентацию















 Русско–турецкая война 1877-1878 гг
Русско–турецкая война 1877-1878 гг Язык XML
Язык XML Вопросы, заданные человечеству войной
Вопросы, заданные человечеству войной ФГБОУ ВПО «Пермский государственный институт искусства и культуры» Факультет Культурологии Кафедра Управления и экономики СКС
ФГБОУ ВПО «Пермский государственный институт искусства и культуры» Факультет Культурологии Кафедра Управления и экономики СКС  Только школа способна спасти современную цивилизацию…
Только школа способна спасти современную цивилизацию… WiNet безпроводной интернет.
WiNet безпроводной интернет. Системы управления состоянием автомобильных дорог
Системы управления состоянием автомобильных дорог Внедрение ФГОС в начальной школе педагогический совет
Внедрение ФГОС в начальной школе педагогический совет 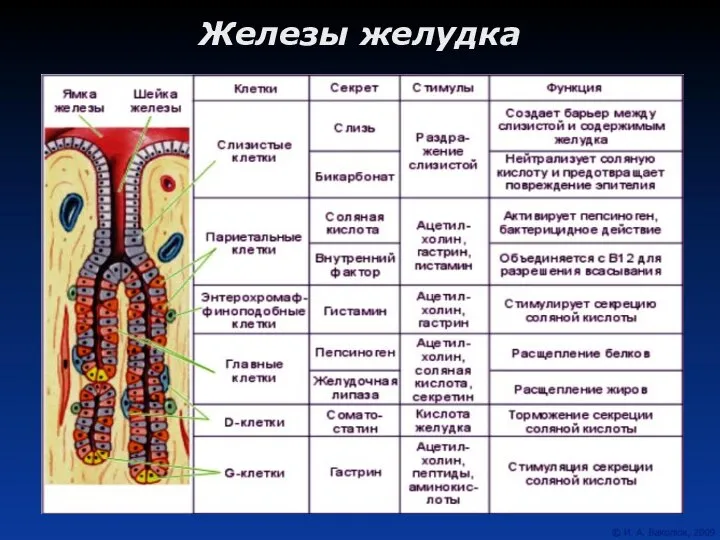 Железы желудка
Железы желудка Судебное дело Выполнили :Хропина Ольга и Фунтикова Виктория
Судебное дело Выполнили :Хропина Ольга и Фунтикова Виктория Сетевые протоколы
Сетевые протоколы Презентация Отказ в пользу государства - таможенная процедура
Презентация Отказ в пользу государства - таможенная процедура Адамзаттың ғаламдық мәселелері туралы жалпы түсінік, негізгі ғаламдық мәселелерге шолу
Адамзаттың ғаламдық мәселелері туралы жалпы түсінік, негізгі ғаламдық мәселелерге шолу Тема № 11 Создание организаций
Тема № 11 Создание организаций  Генераторы
Генераторы  Формы, методы и средства развития гибкости футболистов 8-10 лет
Формы, методы и средства развития гибкости футболистов 8-10 лет Геодезическая подготовка к перенесению трассы в натуру
Геодезическая подготовка к перенесению трассы в натуру Виды современных компьютеров
Виды современных компьютеров Программирование и разработка веб-приложений. Использование Python для работы с базой данных
Программирование и разработка веб-приложений. Использование Python для работы с базой данных Презентация "платформа для продвижения потребительских товаров в России." - скачать презентации по Экономике
Презентация "платформа для продвижения потребительских товаров в России." - скачать презентации по Экономике Тензорезисторы. Классификация тензорезисторов
Тензорезисторы. Классификация тензорезисторов Презентация на тему "Композиция"
Презентация на тему "Композиция" Определение показателей разработки газоконденсатной залежи при заводнении
Определение показателей разработки газоконденсатной залежи при заводнении Інженерні споруди для укріплення
Інженерні споруди для укріплення Дом мечты
Дом мечты Воинские звания военнослужащих ВС РФ
Воинские звания военнослужащих ВС РФ Вирусы
Вирусы Ремонт выхлопной системы Ваз-2170. (Часть 1)
Ремонт выхлопной системы Ваз-2170. (Часть 1)