АЛКИНЫ Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. CnH2n-2
Содержание
- 2. ФОРМУЛЫ И НАЗВАНИЯ АЛКИНОВ.
- 3. ИЗОМЕРИЯ АЛКИНОВ. Изомерия положения тройной связи (начиная с С4Н6): Изомерия углеродного скелета ( с С5Н8): Межклассовая
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые
- 5. СТРОЕНИЕ АЦЕТИЛЕНА. Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом
- 6. СТРОЕНИЕ АЦЕТЕЛЕНА. По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию
- 7. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции присоединения. 1) Гидрирование осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd
- 8. 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее,
- 9. 4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал
- 10. Правило В.В.Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому
- 11. 5) Полимеризация. Алкины ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких
- 12. Кислотные свойства. 6) Водородные атомы ацетилена способны замещаться металлами с образованием ацетиленидов. Так, при действии на
- 13. Окисление. 7) Горение. 2СН≡ СН + 4O2 →CO2 + 2H2O + 3C↓ Так как много углерода
- 14. ПОЛУЧЕНИЕ. 1) В промышленноси ацетилен получают высокотемпературным пиролизом метана. 1500ºС 2CH4 → HC≡CH + 3H2 2)
- 15. 4) Алкины можно получить дегидрогалогенированием дигалогенопроизводных парафинов. Атомы галогена при этом могут быть расположены как у
- 17. Скачать презентацию














 Спектр и блеск – звёздный паспорт
Спектр и блеск – звёздный паспорт Чорні діри
Чорні діри Формули астрономії
Формули астрономії ПРОИСХОЖДЕНИЕ ПЛАНЕТ - презентация по Астрономии скачать бесплатно
ПРОИСХОЖДЕНИЕ ПЛАНЕТ - презентация по Астрономии скачать бесплатно Кого берут в космонавты Познавательная игра для учащихся 5 - 6 классов, посвященная первому полету человека в космос
Кого берут в космонавты Познавательная игра для учащихся 5 - 6 классов, посвященная первому полету человека в космос  Связь показателей гравиметрического поля и угловых коэффициентов гравиметра с фазами Луны
Связь показателей гравиметрического поля и угловых коэффициентов гравиметра с фазами Луны Чому ми бачемо тільки одну половину місяця
Чому ми бачемо тільки одну половину місяця Космические послания
Космические послания Исследование происхождения названий планет и их спутников
Исследование происхождения названий планет и их спутников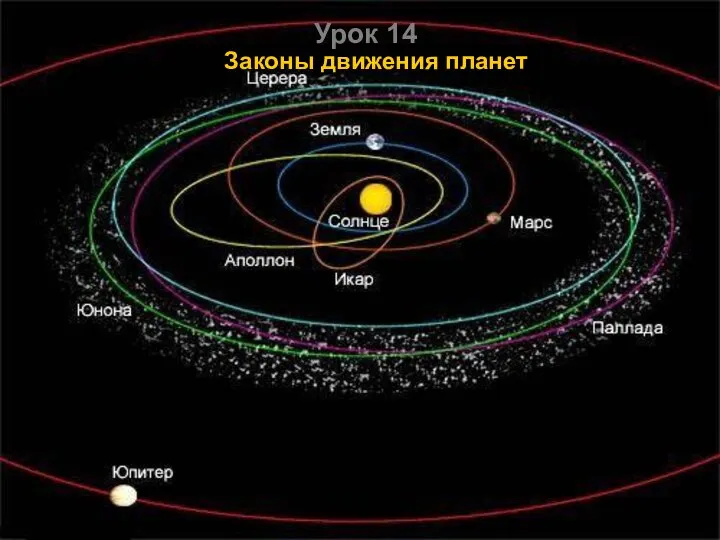 Законы движения планет
Законы движения планет Небесные тела солнечной системы астероиды
Небесные тела солнечной системы астероиды О кометах - презентация по Астрономии скачать бесплатно
О кометах - презентация по Астрономии скачать бесплатно «Иследование Марс»
«Иследование Марс»  Развитие астрономии в начале эпохи нового времени
Развитие астрономии в начале эпохи нового времени SkySat-1,2. Технические характеристики съемочной аппаратуры
SkySat-1,2. Технические характеристики съемочной аппаратуры Космонавтика во время рассвета СССР
Космонавтика во время рассвета СССР Зимние созвездия
Зимние созвездия Что у нас над головой
Что у нас над головой Малые тела Солнечной системы
Малые тела Солнечной системы Отечественная история покорения космоса
Отечественная история покорения космоса Путешествие по Солнечной системе
Путешествие по Солнечной системе Презентация по астрономии Первый искусственный спутник Земли
Презентация по астрономии Первый искусственный спутник Земли  Планеты Солнечной системы
Планеты Солнечной системы Жизнь и разум во Вселенной
Жизнь и разум во Вселенной Uranus. Caracteristici
Uranus. Caracteristici Космос и математика
Космос и математика Что изучает астрономия? - презентация по Астрономии скачать _
Что изучает астрономия? - презентация по Астрономии скачать _ Новые и Сверхновые Звёзды
Новые и Сверхновые Звёзды