Содержание
- 2. Элементарный химический состав В состав белков входят атомы: С, О, Н, N, S
- 3. Белки Белки – нерегулярные полимеры, мономерами для которых являются аминокислоты. Аминокислоты – органические соединения, имеющие в
- 5. Аминокислоты Всего в природе встречается около 170 различных аминокислот, однако в состав белков входит лишь 20.
- 6. Белки Каждый белок имеет строго индивидуальную последовательность аминокислотных остатков. Двадцати аминокислот достаточно, чтобы создать необычайное разнообразие
- 7. Белки В составе белков аминокислоты соединяются между собой с образованием пептидной связи: R2
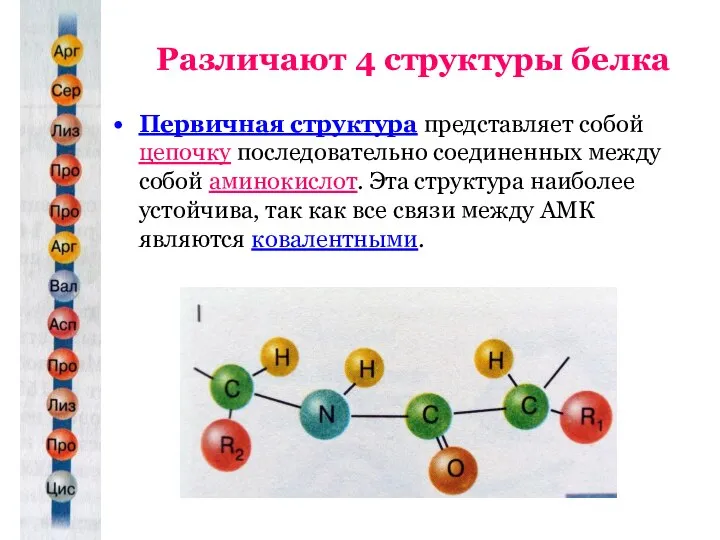
- 8. Различают 4 структуры белка Первичная структура представляет собой цепочку последовательно соединенных между собой аминокислот. Эта структура
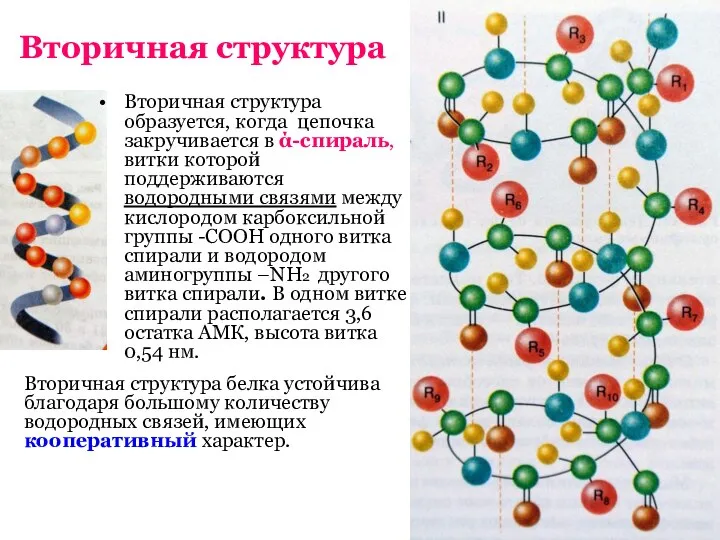
- 9. Вторичная структура Вторичная структура образуется, когда цепочка закручивается в ά-спираль, витки которой поддерживаются водородными связями между
- 10. Третичная структура Третичная структура представляет собой еще более компактную молекулу. Нить АМК далее свертывается, образуя клубок
- 11. Четвертичная структура Например, в составе гемоглобина таких полипептидных цепочек четыре – 2 ά- цепи и 2
- 12. Денатурация белков Начиная со вторичной структуры, пространственная конформация макромолекул белка поддерживается, в основном, слабыми химическими связями.
- 13. Функции белков 1. Каталитическая. Почти все ферменты являются белками. Для названия большинства ферментов характерен суффикс –аза,
- 14. Функции белков 2. Структурная. Белки входят в состав мембраны клеток. 3. Транспортная. Белки связывают различные вещества
- 15. Функции белков 5. Сократительная. Все типы активного движения всегда связаны с белками. Актин и миозин входят
- 16. Функции белков 11. Защитная: А) структурные белки, обеспечивающие механическую прочность тканей (кератин, коллаген). Б) ферменты разрушают
- 18. Скачать презентацию













 «Практическая биология, или биология в профессии» курс предпрофильной подготовки
«Практическая биология, или биология в профессии» курс предпрофильной подготовки Презентация на тему "Самые большие животные в мире" - скачать бесплатно презентации по Биологии
Презентация на тему "Самые большие животные в мире" - скачать бесплатно презентации по Биологии Пеликозавры
Пеликозавры Захворювання серцево-судинної системи
Захворювання серцево-судинної системи  Агрессия собак, как вид социального поведения
Агрессия собак, как вид социального поведения 60 секунд. Животный мир
60 секунд. Животный мир Питание и дыхание бактерий
Питание и дыхание бактерий Элодея Канадская
Элодея Канадская Гранат - король всех плодов (окружающий мир, 2 класс)
Гранат - король всех плодов (окружающий мир, 2 класс) Презентация на тему Жиры
Презентация на тему Жиры Мышцы нижней конечности
Мышцы нижней конечности Презентация по теме «Центры происхождения культурных растений». 10 класс Учитель биологии Фоменко А.Н.
Презентация по теме «Центры происхождения культурных растений». 10 класс Учитель биологии Фоменко А.Н.  Презентация на тему Агроценозы
Презентация на тему Агроценозы  Человек умелый
Человек умелый Классификация газонов и дерновых покрытий
Классификация газонов и дерновых покрытий Введение в эстезиологию. Органы чувств в свете учения И.П. Павлова об анализаторах. Орган зрения
Введение в эстезиологию. Органы чувств в свете учения И.П. Павлова об анализаторах. Орган зрения Птицы России. Дятел
Птицы России. Дятел Урок биологии в 6 классе Тема: Общая характеристика грибов. Питание, дыхание, споровое размножение грибов. Многоклеточные гриб
Урок биологии в 6 классе Тема: Общая характеристика грибов. Питание, дыхание, споровое размножение грибов. Многоклеточные гриб Презентация на тему "Какие бывают собаки?" - скачать презентации по Биологии
Презентация на тему "Какие бывают собаки?" - скачать презентации по Биологии Принципы строения скелета и хвоста у животных
Принципы строения скелета и хвоста у животных Одноклеточные организмы Protista
Одноклеточные организмы Protista Презентация на тему "Раковины моллюсков (строение и разнообразие)" - скачать презентации по Биологии
Презентация на тему "Раковины моллюсков (строение и разнообразие)" - скачать презентации по Биологии Тип кольчатые черви, класс малощетинковые
Тип кольчатые черви, класс малощетинковые Йогурт және оның тағамдық, биологиялық құндылығы
Йогурт және оның тағамдық, биологиялық құндылығы Животные РА
Животные РА Вирусные Заболевание животных Выполнила: ученица 10 класса Мусиенко Кристина
Вирусные Заболевание животных Выполнила: ученица 10 класса Мусиенко Кристина  Железы внешней, внутренней и смешанной секреции
Железы внешней, внутренней и смешанной секреции Строение листа
Строение листа