Содержание
- 2. Диапазон температур, действующих в природе на растения, достаточно широк: от –77°С до +55°С, т.е. составляет 132°С
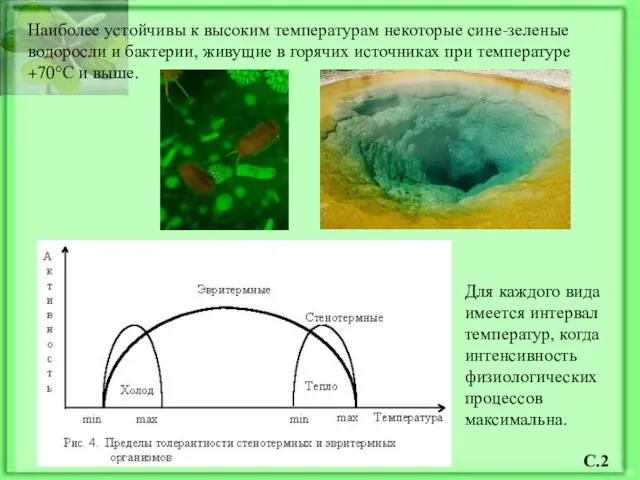
- 3. Наиболее устойчивы к высоким температурам некоторые сине-зеленые водоросли и бактерии, живущие в горячих источниках при температуре
- 4. Растения относят к пойкилотермным организмам, у которых температура тела меняется в зависимости от температуры окружающей среды.
- 5. Организмы в зависимости от температурного оптимума: термофильные (выше 50°С), теплолюбивые (25-50°С), умеренно теплолюбивые (15-25°С) холодолюбивые (5-15°С).
- 6. Влияние высокой температуры на физиологические процессы прямое влияние t° изменение скорости диффузии изменение скорости химических реакций
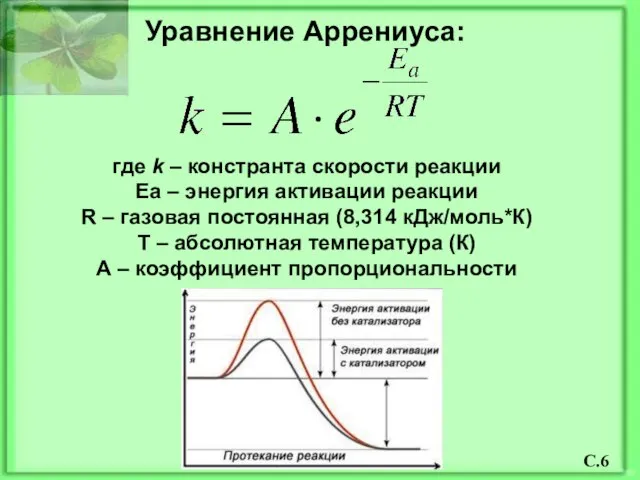
- 7. Уравнение Аррениуса: где k – констранта скорости реакции Ea – энергия активации реакции R – газовая
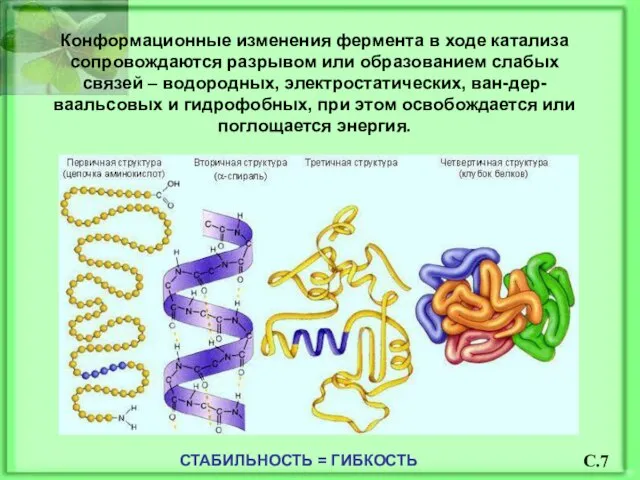
- 8. Конформационные изменения фермента в ходе катализа сопровождаются разрывом или образованием слабых связей – водородных, электростатических, ван-дер-ваальсовых
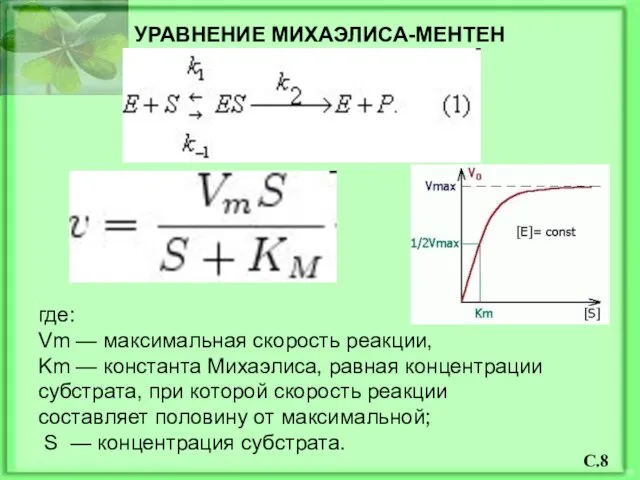
- 9. где: Vm — максимальная скорость реакции, Km — константа Михаэлиса, равная концентрации субстрата, при которой скорость
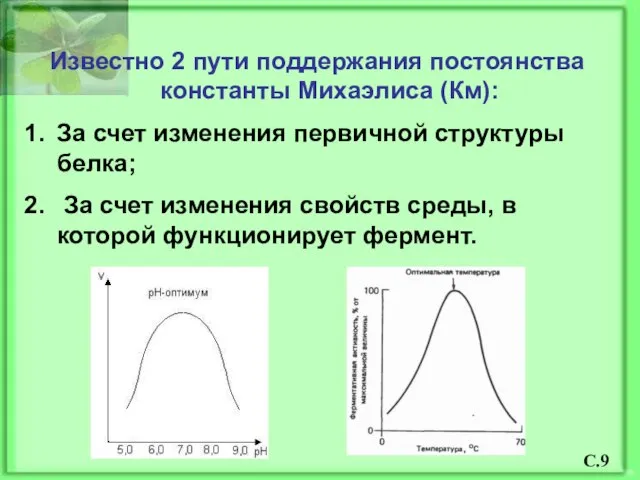
- 10. Известно 2 пути поддержания постоянства константы Михаэлиса (Км): За счет изменения первичной структуры белка; За счет
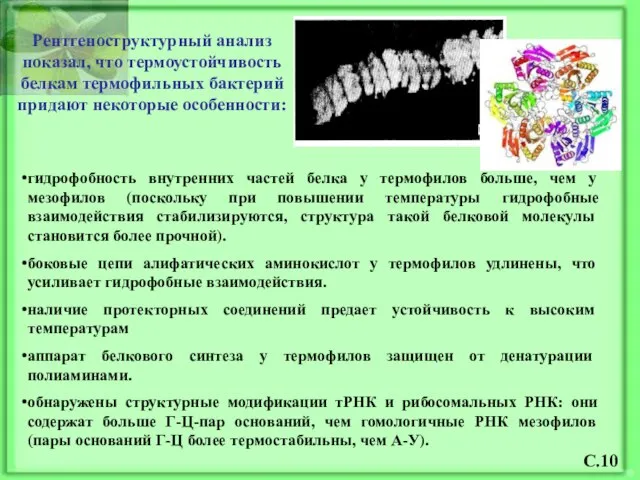
- 11. гидрофобность внутренних частей белка у термофилов больше, чем у мезофилов (поскольку при повышении температуры гидрофобные взаимодействия
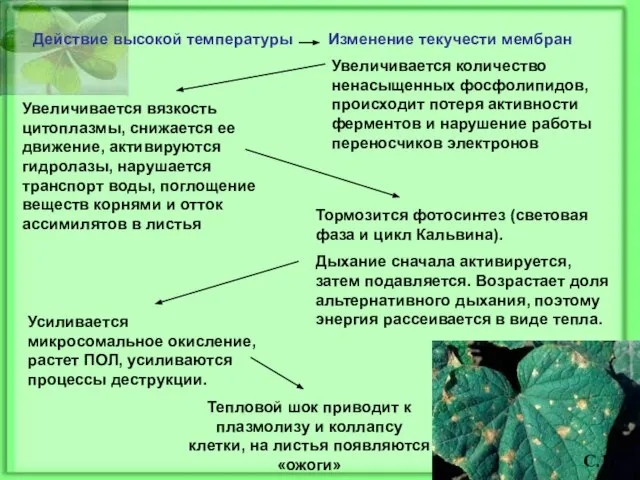
- 12. Действие высокой температуры Изменение текучести мембран Увеличивается количество ненасыщенных фосфолипидов, происходит потеря активности ферментов и нарушение
- 13. При высоких температурах работают защитные механизмы двух типов: избежание перегрева за счет анатомических приспособлений ксероморфная структура
- 14. Жаростойкие растения отличаются: значительным содержанием прочносвязанной воды, что приводит к высокой вязкости цитоплазмы наличием осмотически активных
- 15. C.14 Изменение степени ненасыщенности жирных кислот и длины ацильных цепей в липидах контролируется с помощью ферментов:
- 16. Белки теплового шока (БТШ) Это специфические белки, вырабатываемые у организмов в ответ на действие высоких температур
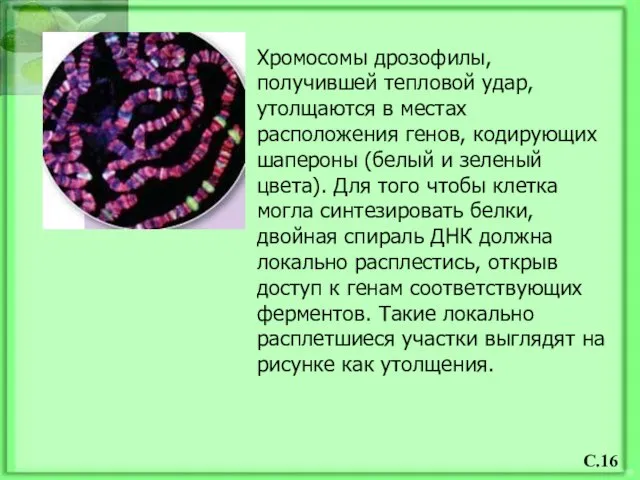
- 17. Хромосомы дрозофилы, получившей тепловой удар, утолщаются в местах расположения генов, кодирующих шапероны (белый и зеленый цвета).
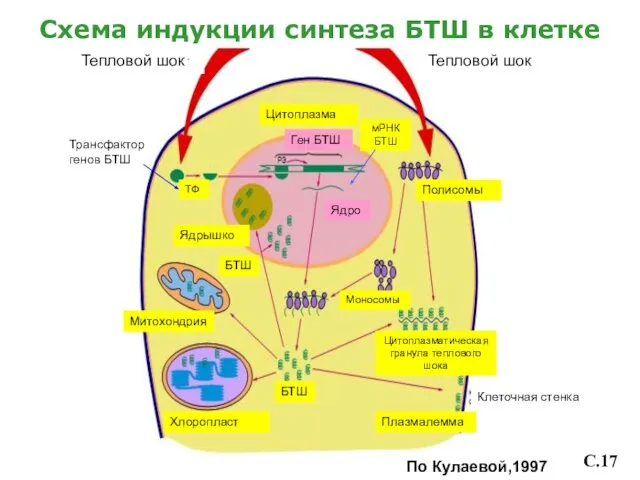
- 18. Схема индукции синтеза БТШ в клетке Тепловой шок Цитоплазма Митохондрия Тепловой шок Ген БТШ Хлоропласт Моносомы
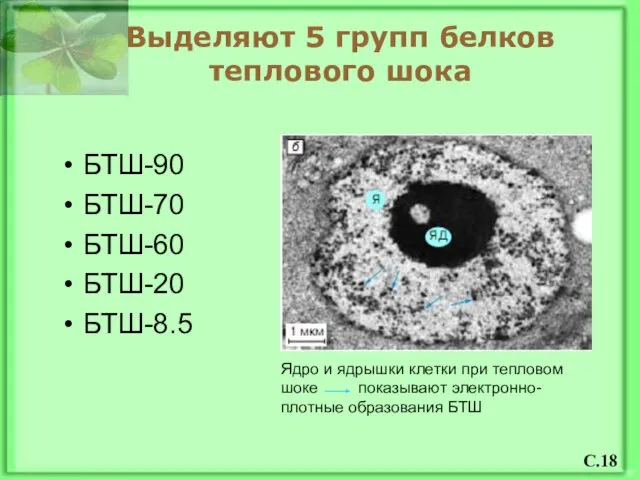
- 19. Выделяют 5 групп белков теплового шока БТШ-90 БТШ-70 БТШ-60 БТШ-20 БТШ-8.5 Ядро и ядрышки клетки при
- 20. В соответствии моделью молекулярного «шаперона» БТШ обеспечивают следующие процессы: АТФ-зависимую стабилизацию нативной пространственной структуры белков правильную
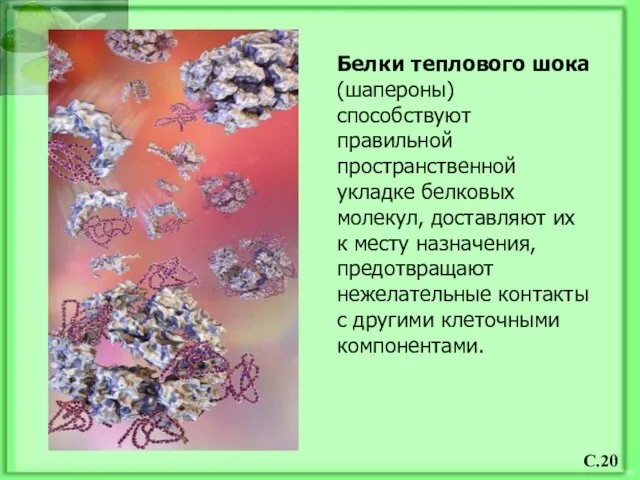
- 21. Белки теплового шока (шапероны) способствуют правильной пространственной укладке белковых молекул, доставляют их к месту назначения, предотвращают
- 23. Скачать презентацию









 Съедобное и несъедобное
Съедобное и несъедобное Презентация на тему "Зима в лесу" - скачать бесплатно презентации по Биологии
Презентация на тему "Зима в лесу" - скачать бесплатно презентации по Биологии Чистота и здоровье человека Выполнили: Ходыкина Ю., Лобода М., Погорелова О.
Чистота и здоровье человека Выполнили: Ходыкина Ю., Лобода М., Погорелова О. Сцепление генов и картирование хромосом
Сцепление генов и картирование хромосом Экология жағдайларына бейімделу
Экология жағдайларына бейімделу Презентация на тему "Физиология в рисунках и схемах Модуль 4 Физиология дыхания" - скачать презентации по Биологии
Презентация на тему "Физиология в рисунках и схемах Модуль 4 Физиология дыхания" - скачать презентации по Биологии Взаимодействие генов и их множественное действие
Взаимодействие генов и их множественное действие Стовбурові клітини
Стовбурові клітини  Өткізгіш ұлпаның құрлысы мен қызметі
Өткізгіш ұлпаның құрлысы мен қызметі Компьютерные методы анализа нуклеотидных последовательностей
Компьютерные методы анализа нуклеотидных последовательностей Породы кроликов
Породы кроликов Взаимодействие аллельных и неаллельных генов
Взаимодействие аллельных и неаллельных генов Скелет птиц
Скелет птиц Живі фільтри. Губки
Живі фільтри. Губки Презентация на тему "Сон и сновидения" - скачать бесплатно презентации по Биологии
Презентация на тему "Сон и сновидения" - скачать бесплатно презентации по Биологии Презентация на тему Разнообразие и распространение организмов на Земле
Презентация на тему Разнообразие и распространение организмов на Земле  Ткани
Ткани Презентация на тему Побег» Биология 6 класс
Презентация на тему Побег» Биология 6 класс  Класс Однодольные, характерные признаки растений семейства злаковых
Класс Однодольные, характерные признаки растений семейства злаковых Презентация на тему Эволюция человека
Презентация на тему Эволюция человека Презентация на тему "Гемостаз" - скачать презентации по Биологии
Презентация на тему "Гемостаз" - скачать презентации по Биологии Биологический уровень организации материи 10 класс. Естествознание.
Биологический уровень организации материи 10 класс. Естествознание. Molecular Biology
Molecular Biology Внутреннее строение, размножение и развитие рыб
Внутреннее строение, размножение и развитие рыб Основы биоакустики. Ультразвук и его применение в медицине
Основы биоакустики. Ультразвук и его применение в медицине Приспособления животных к среде обитания
Приспособления животных к среде обитания  ТЕМА: ВИТАМИНЫ - ЧУДЕСНЫЕ ВЕЩЕСТВА Батршина Зульфия Рафигатовна Учитель биологии МОУ «Аминевская СОШ» Уйского района Челябинско
ТЕМА: ВИТАМИНЫ - ЧУДЕСНЫЕ ВЕЩЕСТВА Батршина Зульфия Рафигатовна Учитель биологии МОУ «Аминевская СОШ» Уйского района Челябинско Конструктивный метаболизм микроорганизмов
Конструктивный метаболизм микроорганизмов